SQLITE NOT INSTALLED
Часто задаваемые вопросы
Среднее время пребывания в стационаре 3-4 дня. Как правило, в день поступления утром вы проходите обследование, включающее в себя клинический и биохимический анализ крови (приезжать нужно натощак), делаете рентгеновский снимок, ЭКГ, ультразвуковое исследование сердца и консультацию кардиолога и кардиохирурга. Если все показатели в норме, на следующий день проводится операция по устранению порока. На третий день мы проводим контрольные исследования и выписываем Вас.
Для госпитализации в наш стационар вам понадобится паспорт или свидетельство о рождении ребенка.
Если пациент детского возраста, нужна справка о санэпидокружении (о том, что в последнее время ребенок не контактировал с инфицированными больными), которую вы получите в поликлинике по месту жительства.
Желательно иметь при себе предыдущие консультативные заключения, ЭКГ и рентгеновский снимок органов грудной.
Направление от кардиолога по месту жительства НЕ ТРЕБУЕТСЯ. Вы можете приехать на консультацию и последующее лечение в порядке самообращения. Если Вам более 30 лет или вы ощущали перебои в работе сердца, желательно провести холтеровское мониторирование по месту жительства. Такое исследование можно провести и у нас, но это увеличит Ваше время пребывания в стационаре на 1-2 дня.
Если вы страдаете хроническим гастритом, язвенной болезнью желудка или двенадцатиперстной кишки необходимо сделать фиброгастродуоденоскопию. В случае подтверждения заболевания, Вам необходимо пройти курс лечения по месту жительства. Такое исследование можно провести и у нас, но это увеличит Ваше время пребывания в стационаре на 1-2 дня в случае отсутствия язв и эррозий.
Как правило, длительность операции в пределах 1-1,5часа. Но при сложных анатомических вариантах время операции может увеличится.
Всем взрослым пациентам операция проводится под местной анестезией. Пациент может наблюдать за ходом операции и общаться с персоналом. Исключение составляют пациенты с дефектом межпредсердной перегородки, которым во время операции требуется контроль транспищеводного УЗИ и для комфорта пациента операция проводится в состоянии медикаментозного сна. Все эндоваскулярные операции у детей и мнительных пациентов проводятся под общей анестезией.
Самый неприятный момент — это укол местного анестетика в паховую область. Затем болевая чувствительность полностью исчезает.
Через 3-6 месяцев имплантированные устройства полностью прорастают своими клетками — покрываются эндотелием и их уже не отличить от внутренней поверхности сердца. Все устройства выполнены из высокотехнологичного медицинского сплава, который не вызывает реакций отторжения или аллергических реакций.
Нет, установленные устройства не ощущаются.
Да, на КТ ограничений нет. На МРТ производители имплантов гарантируют безопасность при 1,5 и 3 Тесла. Перед обследованием обязательно сообщите радиологу о том, что у Вас установлен внутрисердечный имплант.
Необходимо ограничить сильную физическую нагрузку на 6 месяцев. Необходима профилактика респираторных инфекций, тонзиллита, кариеса. В случае, если заболевание начало развиватьс я, в схему лечения нужно включить антибактериальные препараты, после консультации с врачом. В течении первого месяца после операции необходимо также ограничить половую жизнь.
Немедленно вызовите скорую помощь, указав по телефону какой вид операции Вы перенесли. Затем перезвоните врачу, который делал операцию.
Аномалии положения сердца плода
Среди аномалий расположения сердца выделяют эктопию сердца (размещение вне грудной клетки). К таким патологиям относят декстрокардию (смещение сердца в правую сторону относительно нормального положения) и мезокардию (расположение сердца не с левой стороны грудины, а по срединной линии тела).
Эктопия сердца у плода возникает на сроке 14-18 дней с момента зачатия мезадерма начинает развиваться неправильно, что вызывает неправильное срастание брюшной стенки. У плода либо отсутствует диафрагма вообще, либо нет диафрагмального сегмента перикарда.
Из-за отверстия в стенке между правым и левым желудочком слышны интракардиальные шумы. Также у плода эктопия сердца нередко сопровождается другими аномалиями — гидроцефалией, энцефалоцеле и пр.
Надо сказать, что существует высокая вероятность ошибочного диагноза по установки положения сердца. При тазовом предлежании плода на УЗИ сердца визуализируется справа, хотя на самом деле оно располагается в положенном месте.
В 71% случаев эктопия сердца вызывается плевральным выпотом, кистозным аденоматозным пороком развития лёгкого, диафрагмальной грыжей.
Различают четыре вида эктопии:
- абдоминальная (сердце находится в брюшине);
- грудная (сердце выходит наружу через дефекты грудины);
- торакоабдоминальная (пентада Кантрелла – сложнейшая патология, имеющая комплекс отклонений от нормы);
- шейная (сердце смещается в область сердца).
Грудная эктопия встречается в 55-60% случаев, торакоабдоминальная — в 38%, шейная — почти в 3%. Выживаемость составляет около 10%. В большинстве случаев при эктопии младенец либо рождается мёртвым, либо умирает сразу после рождения.
Патология сопровождается смещением других внутренних органов, которые не защищены от механических повреждений и подвержены инфекциям и вирусам больше обычного.
Диагностика врожденных пороков сердца
Врач может заподозрить порок сердца случайно, при обычном физикальном осмотре, во время аускультации сердца. Он может услышать специфический шум в сердце, который возникает, когда кровь течет через измененное пороком сердце и/или кровеносные сосуды. Эти шумы нередко слышны через обычный стетоскоп.
Большинство шумов в сердце ребенка являются «невинными» — это означает, что они возникают не по причине ВПС, и не представляют никакой опасности для здоровья ребенка. Однако некоторые шумы могут указывать на ненормальный ток крови в сердце, а значит — на ВПС.
Если после физикального осмотра и сбора анамнеза у врача появилось подозрение на порок сердца, врач может назначить определенные анализы и тесты, для уточнения своих подозрений, например:
Эхокардиография (ЭХО-КГ, УЗИ сердца). Этот метод обследования позволяет врачу увидеть порок сердца, иногда даже до рождения ребенка. Это поможет выбрать оптимальную тактику, заранее госпитализировать вас в специализированную клинику и тд. В этом методе используются ультразвуковые волны, которые проникают в ткани, но не оказывают никакого вреда, ни вам, ни ребенку.
Врач может назначать ЭХО-КГ после рождения ребенка с определенной частотой, чтобы наблюдать динамику изменений в сердце — в тех случаях, когда операция не показана незамедлительно.
Дополнительная информация: Ультразвуковое исследование сердца. Информация для пациентов.
Электрокардиограмма (ЭКГ). Этот неинвазивный тест записывает электрическую активность сердца вашего ребенка и может помочь в диагностике некоторых пороков сердца или проблем с ритмом сердца. Электроды, подключенные к устройству, располагаются на теле вашего ребенка в определенном порядке, и улавливают тончайшие электромагнитные волны, которые исходят из сердца вашего ребенка.
Рентгенография грудной клетки. Врачу может потребоваться снимок грудной клетки вашего ребенка, чтобы увидеть, нет ли увеличения сердца, а также скопления жидкости в легких. Эти симптомы могут указывать на наличие сердечной недостаточности.
Пульсоксиметрия. Этот тест измеряет количество кислорода в крови вашего ребенка. Датчик помещается на кончик пальца вашего ребенка, или прикрепляется к его ножке, и по степени проникновения красного света сквозь ткани — определяет уровень кислорода в крови (сатурацию). Недостаток кислорода в крови может указывать на проблемы с сердцем.
Катетеризация сердца. Иногда врачу требуется проведение инвазивных методик, таких как катетеризация сердца. Для этого тонкая, гибкая трубка (катетер) вводится в крупный кровеносный сосуд в паху ребенка, и проводится по сосудам вверх, до самого сердца.
Катетеризация иногда необходима, поскольку она может дать врачу значительно больше информации об особенностях порока сердца, чем эхокардиография. Кроме того, во время катетеризации сердца, можно выполнить некоторые лечебные процедуры, о чем будет сказано ниже.
Открытый артериальный проток
Что такое открытый артериальный проток (боталлов проток)?
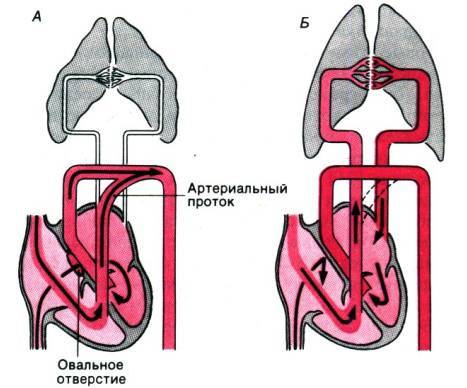
Боталлов проток (Рис 1, Видео 1) – это сосуд, который в норме функционирует у плода и соединяет два магистральных сосуда сердца – аорту и легочную артерию. Существует он для того, что бы кровь могла обойти мимо легкие, которые у внутриутробно не функционируют. В течение первых дней жизни новорожденного малыша боталлов проток в норме закрывается. Иногда случается, что открытый артериальный проток не закрывается, что приводит к ряду неприятных проблем. Проток, который не закрылся в течение месяца жизни ребенка, считается врожденным пороком сердца.
Естественное течение порока. Или к чему приведет открытый боталов проток?
Дело в том, что этот сосуд все еще соединяет два больших сосуда сердца – аорту и легочную артерию. Давление в аорте намного превышает давление в легочной артерии. Поэтому через открытый артериальный проток с аорты в легкие попадает избыточное количество крови, что сначала приведет к частым бронхолегочным заболеваниям, а при очень больших боталловых протоках – к необратимым изменениям в сосудах легких и неоперабельности. Кроме того, большой боталлов проток значительно увеличивает нагрузку на сердце, особенно на левый желудочек. Поэтому затягивать с лечением этого порока нельзя.
Лечение открытого артериального протока.
В настоящее время не существует такого боталлова протока, который нельзя было бы закрыть нетравматичным эндоваскулярным методом, который позволит избежать разреза, шрамов и длительной реабилитации. Хирургическое лечение этого порока осталось в прошлом, хирурги закрывают боталлов проток только недоношенным детям или в странах, где медицина имеет недостаточное финансирование. Во всех развитых странах Европы и Америки этот порок устраняется исключительно эндоваскулярно в ренгеноперационных. К тому же вероятность осложнений при эндоваскулярном лечении намного меньше.
Процедура эндоваскулярного закрытия.
|
Рис 2 – Внешний вид окклюдера |
|
Рис 3 — Внешний вид спирали |
При эндоваскулярном закрытии через маленький прокол в бедренные сосуды в сосуды сердца и в боталлов проток заводятся тоненькие трубочки, так называемые катетеры. Используя рентген и контрастное вещество, доктор оценивает размер и форму боталлова протока, после чего он выбирает самое подходящее окклюзирующее (от англ. Occlusion – закупорка) устройство. В качестве таких устройств могут использоваться окклюдеры (рис 2; Видео 1, 2, 3) или спирали (рис 3; Видео 4, 5, 6).
Выбор устройства для закрытия происходит во время операции, и зависит от размера и формы боталлова протока. Как правило, для больших протоков используются окклюдеры, для маленьких — спирали. В течение полугода окклюзирующие устройства полностью обрастают собственными клеточками сердца, происходит, так называемая, эндотелизация. Сброс через боталлов проток в 90% случаев прекращается сразу же после процедуры, в остальных случаях – по окончанию периода эндотелизации устройства.
Реабилитация после процедуры
1. Пациентов выписывают, как правило, на следующий день после процедуры. 2. В течении 6 месяцев рекомендуется проводить антибиотикопрофилактику инфекционного эндокардита.
У нас наибольший в Украине опыт по эндоваскулярному лечению открытых артериальных протоков – более 300 операций. Мы имеем доступ к оборудованию для закрытия боталлового протока любого размера и формы. Также, специализируемся на лечении дефектов межпредсердной и межжелудочковой перегородок. Для того чтобы попасть к нам на консультацию или госпитализироваться позвоните по одному из телефонов или запишитесь на прием онлайн.
|
Видео 1 — Боталлов проток |
|
Видео 2 – В этой красочной анимации Вы сможете увидеть, как закрывают боталлов проток окклюдером |
|
Видео 3 – Видео из операционной: кровь через открытый боталлов проток (сосуд по центру) попадает из аорты (крупный сосуд справа) в легочную артерию (сосуд слева) |
|
Видео 4 — Видео из операционной: проток перекрыт окклюдером. Сброс крови прекратился |
|
Видео 5 – А в этом видео Вы сможете увидеть, как закрывают боталлов проток спиралью |
|
Видео 6 – Видео из операционной: кровь через открытый боталлов проток (сосуд по центру) попадает из аорты (крупный сосуд справа) в легочную артерию (сосуд слева) |
|
Видео 7 — Видео из операционной: проток перекрыт спиралью. Сброс крови практически прекратился |
Осложнения врожденных пороков сердца
К осложнениям, которые могут возникать у ребенка с ВПС, относятся:
- Хроническая сердечная недостаточность. Это тяжелое осложнение, при котором сердце не способно адекватно перекачивать кровь по всему телу; она развивается у детей с грубыми пороками сердца. Признаками застойной сердечной недостаточности являются: учащенное дыхание и плохой набор веса.
- Замедление роста и развития. Дети со среднетяжелыми и тяжелыми пороками сердца часто отстают в физическом развитии. Они могут не только отставать в росте и силе от своих сверстников, но и запаздывать в нервно-психическом развитии.
- Проблемы с сердечным ритмом. Нарушения сердечного ритма (аритмии) могут быть вызваны как самим врожденным пороком сердца, так и рубцами, которые формируются после операции по исправлению этого порока сердца.
- Цианоз. Если порок сердца приводит к смешиванию крови, богатой кислородом с кровью, бедной кислородом, то у ребенка развивается серовато-голубой цвет кожи, то есть состояние, которое называется цианоз.
- Инсульт. Изредка у некоторых детей с врожденными пороками сердца развивается инсульт, из-за сгустков крови, образующихся в патологических отверстиях сердца, и попадающих по кровотоку в головной мозг. Инсульт является также потенциальным осложнением некоторых корректирующих операций на врожденных пороках сердца.
- Эмоциональные проблемы. У некоторых детей с врожденными пороками сердца развивается ощущение неуверенности в себе и многочисленные эмоциональные проблемы, поскольку они имеют физические ограничения и нередко испытывают трудности в обучении. Если вы заметили длительное угнетенное настроение у вашего ребенка — обсудите это с вашим врачом.
- Необходимость пожизненного наблюдения у врачей. Лечение для детей с ВПС может не закончиться после радикальной операции, и продолжаться всю оставшуюся жизнь.
Таким людям требуется особенное отношение к здоровью и лечению любых заболеваний. Например, у них имеется значительный риск инфекций тканей сердца (эндокардита), сердечной недостаточности или проблем с клапанами сердца. Большинству детей с врожденными пороками сердца будет необходимо регулярное наблюдение у кардиолога на протяжении всей их жизни.
Дополнительная информация: Профилактика инфекционного эндокардита. Информация для пациентов.
Подготовка к визиту врача
Если Ваш ребенок имеет угрожающий жизни врожденный порок сердца, вероятнее всего, это будет выявлено сразу после рождения, или даже до рождения, во время проведения стандартных скрининговых процедур при беременности.
Если Вы стали подозревать наличие порока сердца у ребенка в более позднем возрасте (в младенчестве, или детстве), поговорите с врачом вашего ребенка.
Врач захочет узнать у Вас, чем Вы болели во время беременности, использовали ли какие-либо лекарственные препараты, принимали ли алкоголь во время беременности, а также задаст вопросы относительно остальных факторов риска.
В ожидании визита к врачу, запишите все симптомы, которые Вам кажутся подозрительными, даже если вы считаете их не связанными с предполагаемым пороком сердца. Запишите, когда вы впервые заметили каждый из этих симптомов.
Составьте список всех лекарств, витаминов и биологически активных добавок, которые Вы принимали во время беременности.
Например, Вы можете спросить:
- Какие анализы и тесты необходимы моему ребенку? Требуется ли перед ними какая-либо специальная подготовка?
- Требуется ли моему ребенку лечение, и какое?
- Какие долгосрочные осложнения можно ожидать у моего ребенка?
- Как мы будем отслеживать эти возможные осложнения?
- Если у меня еще будут дети, каков риск развития у них ВПС?
- Есть ли у Вас какие-либо печатные материалы по данной проблеме, которые я бы мог(ла) изучить дома? Какие сайты Вы посоветуете мне посетить, чтобы лучше разобраться в этой проблеме?
Ваш врач, вероятно, задаст вам ряд вопросов. Подготовьтесь заранее к ним, чтобы не терять на вспоминание драгоценное время приема. Например, доктор может спросить:
- Когда Вы впервые заметили эти симптомы у вашего ребенка?
- Когда возникают эти симптомы?
- Эти симптомы наблюдаются постоянно, или время от времени? Что их провоцирует?
- Среди Ваших ближайших родственников есть люди с врожденными пороками сердца?
- Что, по-Вашему, облегчает симптомы у вашего ребенка?
- Отставал ли ранее Ваш ребенок в физическом и нервно-психическом развитии?
Терапия
Основным выбором в терапии заболевания является хирургическое закрытие ОАП.Методики закрытия ОАП развиваются начиная с первого сообщения наложения лигатуры Gross и Hubbard в 1939 году. Приоритет в закрытии ОАП отдается малоинвазивным, транскатетерным методикам, начало которым положили работы Portsmann и Ivalon в 1967 году. Результаты транскатетерной обструкции ОАП превосходные. Общая частота закрытия при длительном наблюдении превышает 90-95% в большинстве исследований . Даже когда сохраняется маленькое остаточное шунтирование, полная обструкция может быть достигнута в дальнейшем размещением дополнительного устройства . Серьезные осложнения транскатетерного закрытия ОАП являются редкими. Самое частое осложнение – эмболизация окклюдером, что относительно часто наблюдалось в ранних исследованиях. Другие потенциально важные осложнения – турбуленция потока в проксимальной части левой легочной артерии или нисходящей аорте от выпирающего устройства, гемолиз при высокоскоростном резидуальном шунтировании, тромбоз бедренной артерии или вены, связанный с сосудистой инфекцией. Хирургические операции с наложением лигатуры или разделением ОАП остаются терапией выбора для очень больших протоков. Редко большой проток по типу аортолегочного окна может иметь недостаточную длину, чтобы разместить лигатуру, поэтому соответствующим хирургическим вмешательством является наложение заплаты . Общая частота эффективности хирургического закрытия в опубликованных отчетах располагаются от 94 до 100%, с 0-2%-ной смертностью . Серьезные осложнения включают кровотечение, пневмоторакс, инфекцию и, редко, наложение лигатуры на левую легочную артерию или аорту .
Считается, что закрытие ОАП показано у любого ребенка или взрослого, у которого развивается симптоматика в результате шунтирования. У бессимптомных пациентов с существенным шунтированием слева направо, сопровождающегося увеличением левых отделов, закрытие протока показано, чтобы снизить риск последующих осложнений . У пациентов с синдромом Эйзенменгера после закрытия протока может наблюдаться ухудшение гемодинамики в результате утраты сброса крови справа налево и еще большего повышения давления в легочной артерии, что сопровождается снижением сердечного выброса и нарастанием правожелудочковой недостаточности.
Профилактика инфекционного эндокардита рекомендуется у всех лиц с функционирующим протоком, а также у лиц с остаточным, послеоперационным шунтированием .
В отношении тактики ведения немых протоков существует определенный разброс во мнениях. Некоторые авторы предлагают считать немой ОАП вариантом нормального физиологического развития, так же, как, тривиальную митральную регургитацию, которая не требует никакой терапии . С другой стороны, описаны случаи инфекционного эндартериита немого протока , поэтому таким пациентам может быть предложена не только профилактика инфекционного эндокардита, но и транскатетерное закрытие, особенно у молодых людей .
Таким образом, при общем благоприятном прогнозе тактика дальнейшего ведения больных с немым ОАП остается не совсем ясной, что требует дальнейшего обобщения данных результатов наблюдения, а возможно, и проведения крупномасштабного исследования .
Литература
1. И.Н. Митина, Ю.И. Бондарев. Неинвазивная ультразвуковая диагностика врожденных пороков сердца. Атлас. М. Видар-М. 2004.
2. Х. Фейгенбаум. Эхокардиография. 5-е издание. М. Видар. 1999.
3. Н. Шиллер, М.А. Осипов. Клиническая эхокардиография. Второе издание. М. Практика. 2005.
4. Caplin J.L. Small ductus arteriosus. Heart 1993; 70;98.
5. Deanfield J., Thaulow E., Warnes C., et al. The Task Force on the Management of Grown Up Congenital Heart Disease of the European Society of Cardiology. Eur Heart J 2003; V24 (N11): 1035-1084.
6. Houston A.B., Gnanapragasam J.P., Lim M.K., et al. Doppler ultrasound and the silent ductus arteriosus. Heart 1991; 65; 97-99.
7. Houston A., Hillis S., Lilley S., et al. Echocardiography in adult congenital heart disease. Heart 1998; 80 (Suppl 1): S12-S26.
8. Parthenakis F.I., Kanakaraki M.K., Vardas P.E. Silent patent ductus arteriosus endarteritis. Heart 2000; 84:619.
9. Schneider D.J., Moore J.W. Patent Ductus Arteriosus. Circulation 2006; 114:1873-1882.
Тромбы в левых отделах сердца
Чаще всего тромбы в левых полостях сердца встречаются на фоне трех заболеваний.
В зоне риска находятся люди:
- со стенозом митрального клапана;
- с мерцательной аритмией (фибрилляцией предсердий):
- с постинфарктной аневризмой левого желудочка.
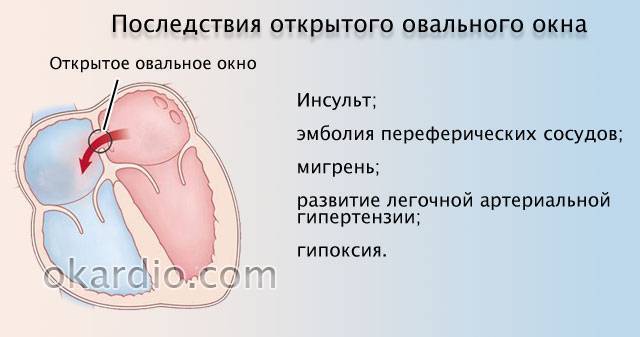
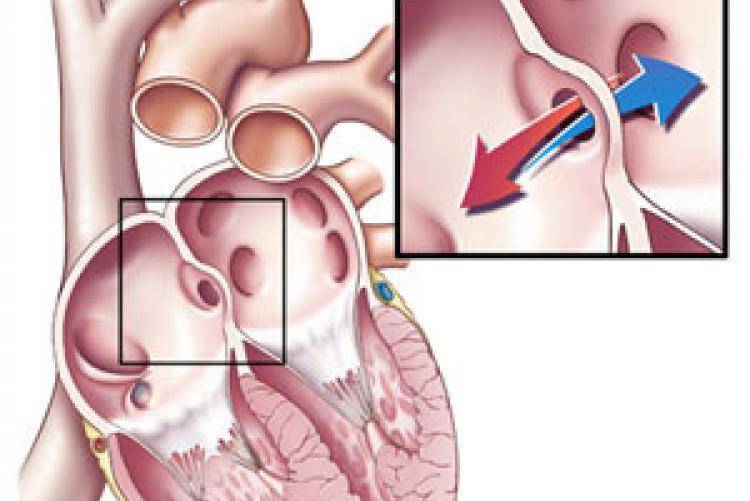
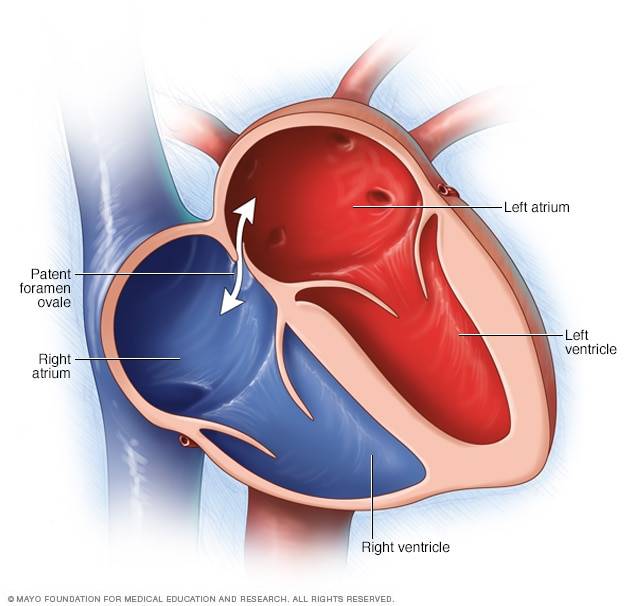
Тромбы в левых отделах сердца – риск возникновения артериальных тромбоэмболий, ишемических атак или инфарктов мозга! При локализации тромбов в левых полостях сердца также могут поражаться артерии почек, верхних и нижних конечностей, артерии кишечника.
Инфаркты и инсульты
Если тромб отрывается, он может распространиться с током крови и закрыть просвет сосуда! При перекрытии сосуда нарушается кровообращение, что приводит к кислородному голоданию и некрозу тканей. Это может вызвать такие осложнения, как инфаркт миокарда, ТЭЛА и даже смерть.
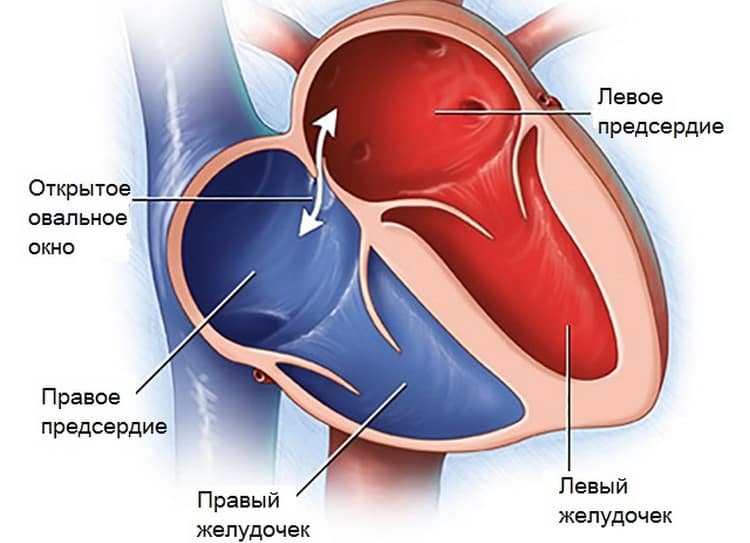
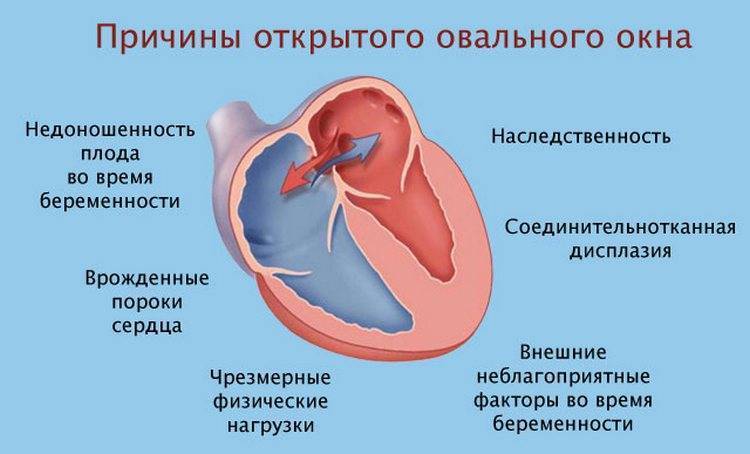
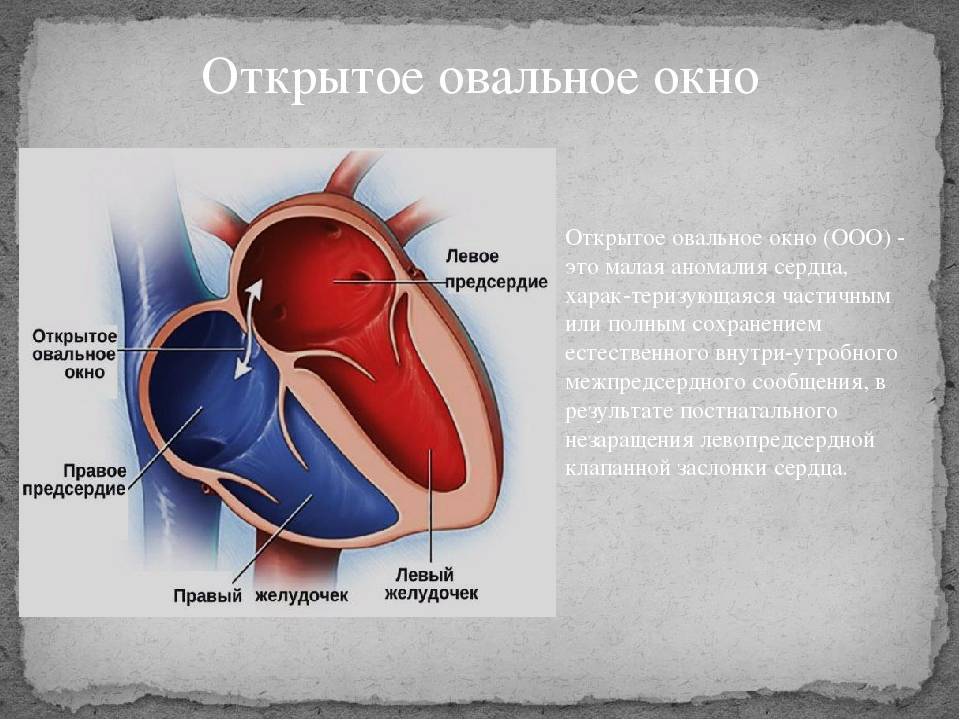
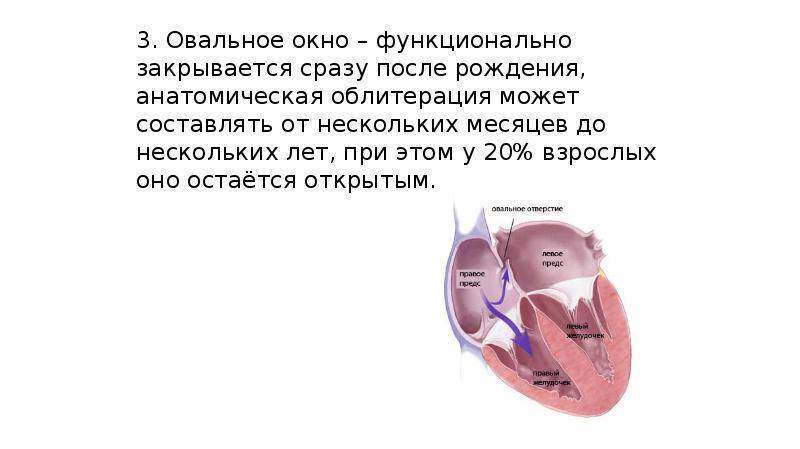
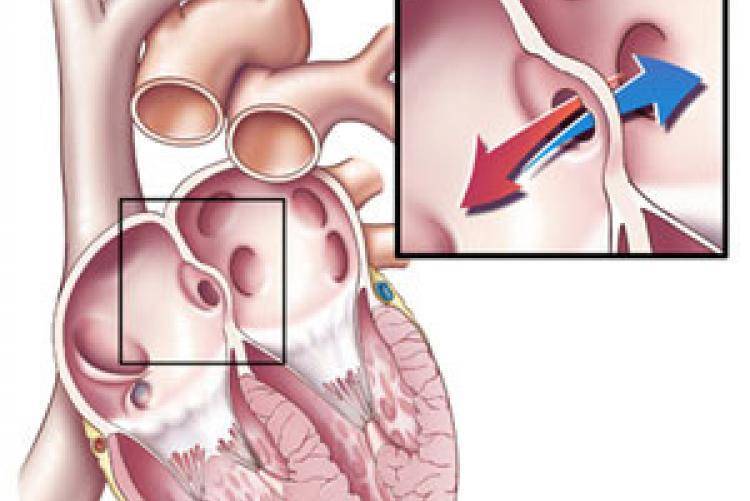
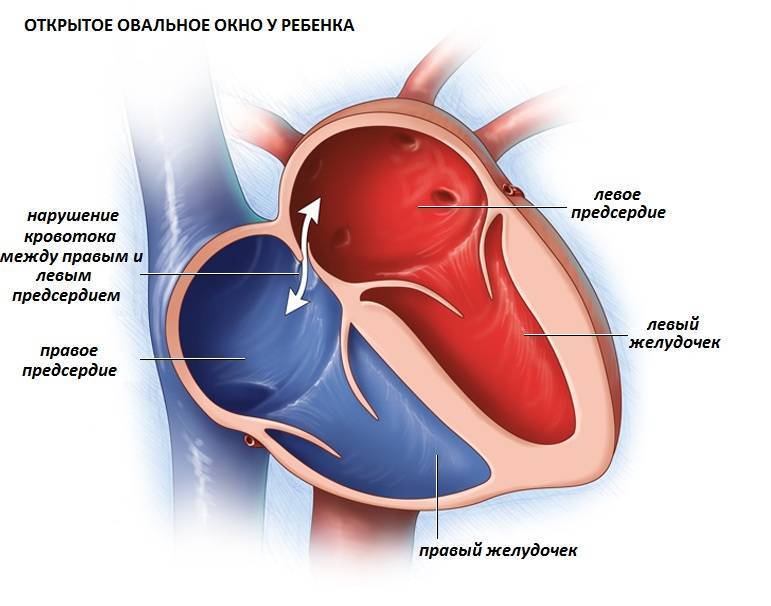
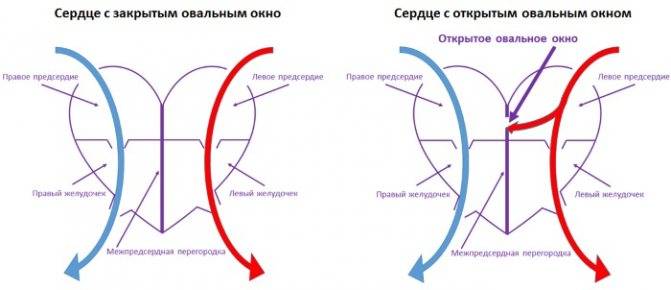
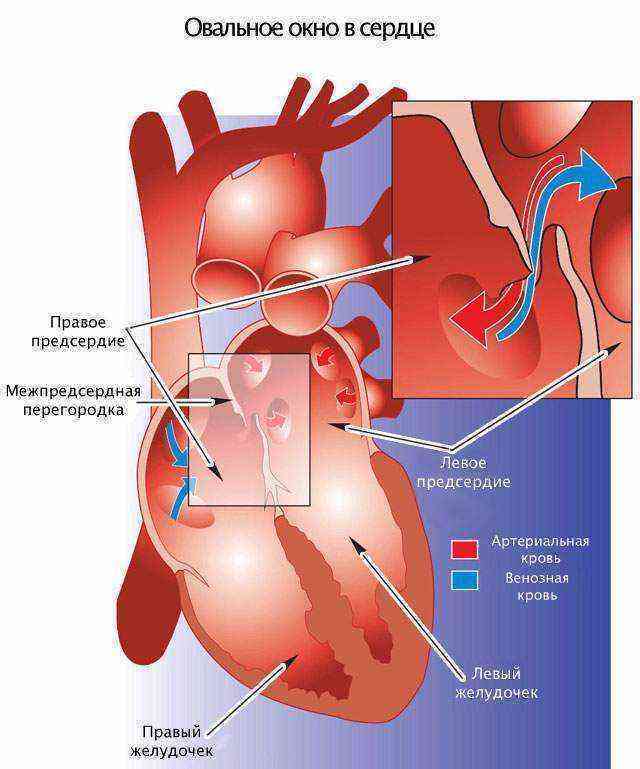
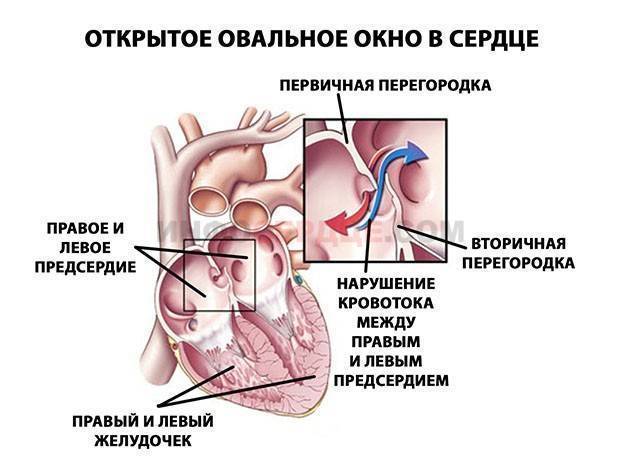
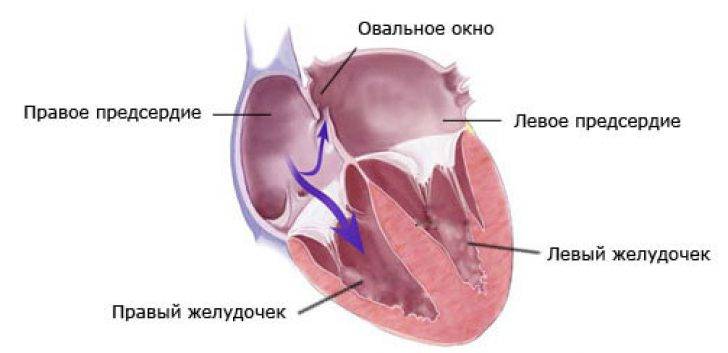
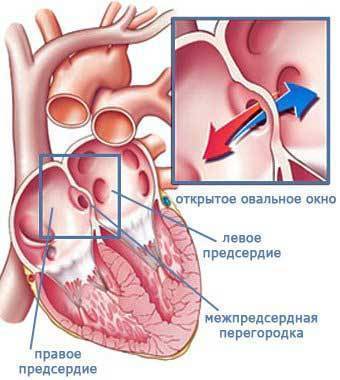
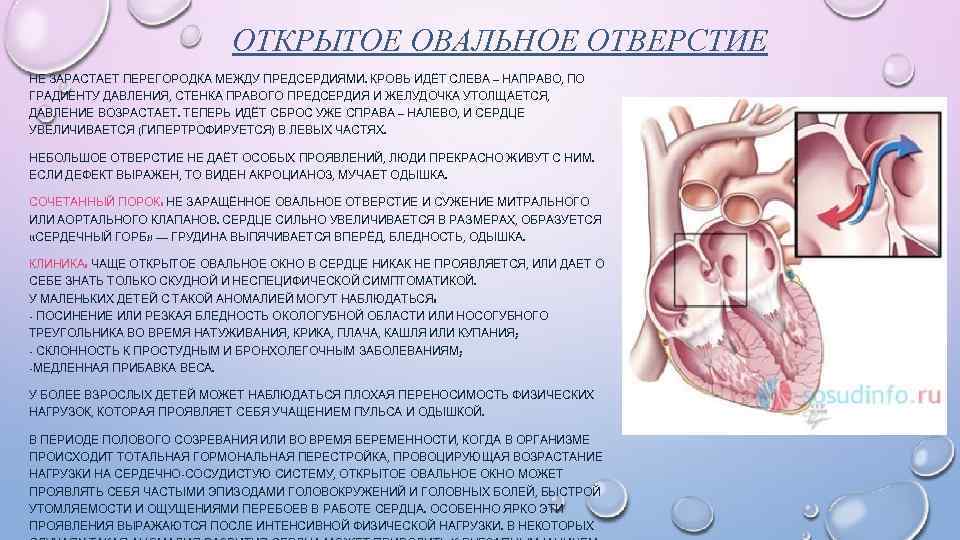
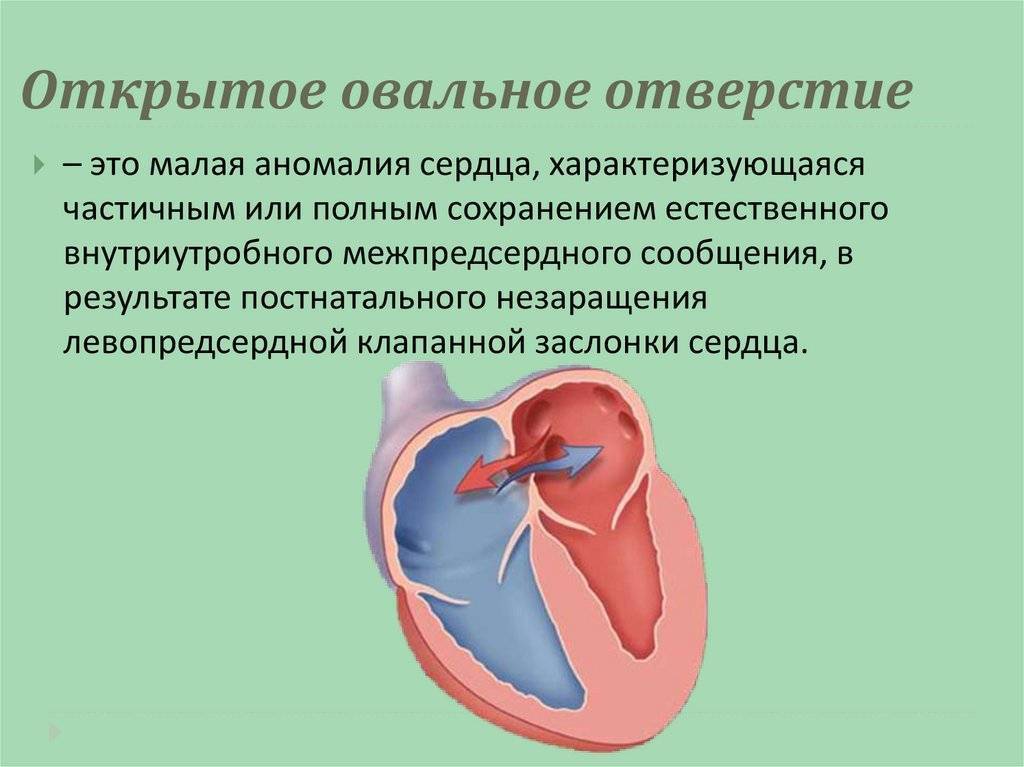
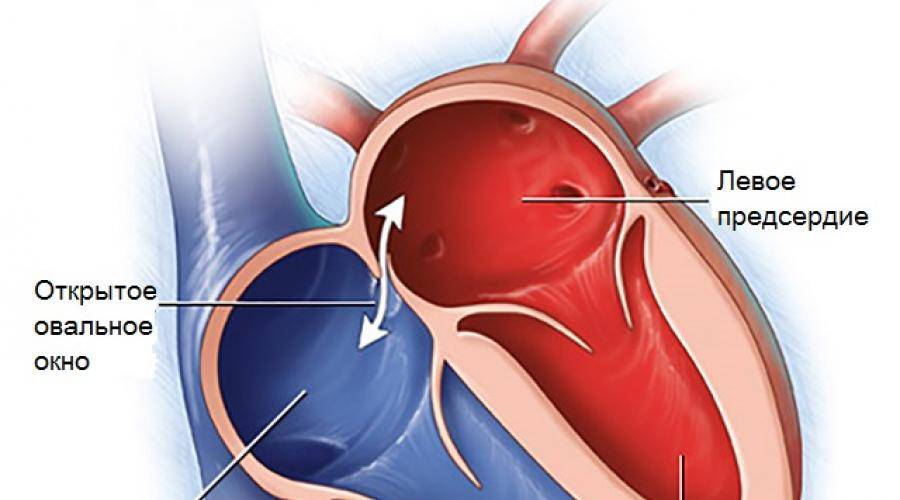
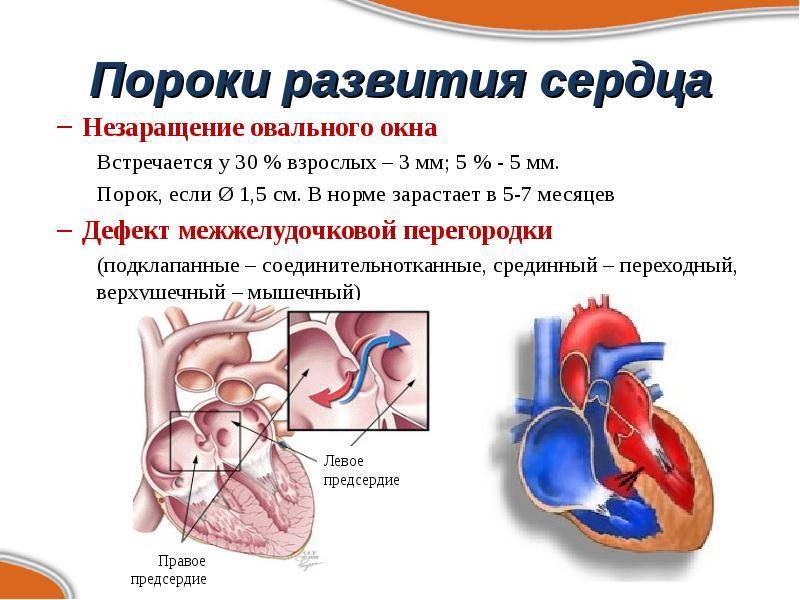
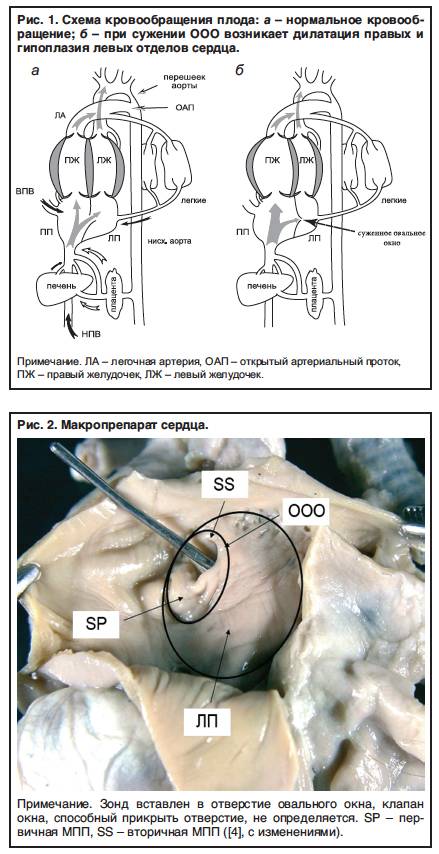
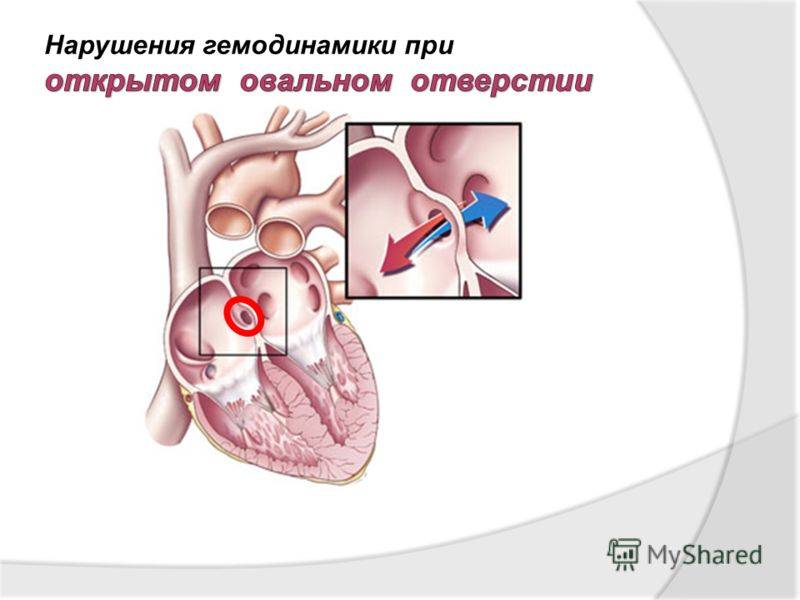
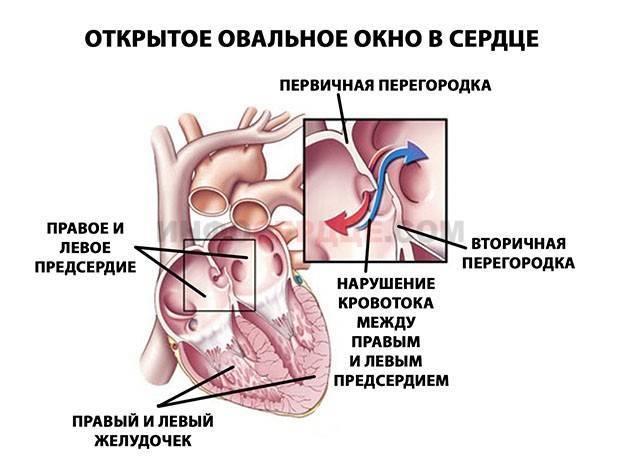
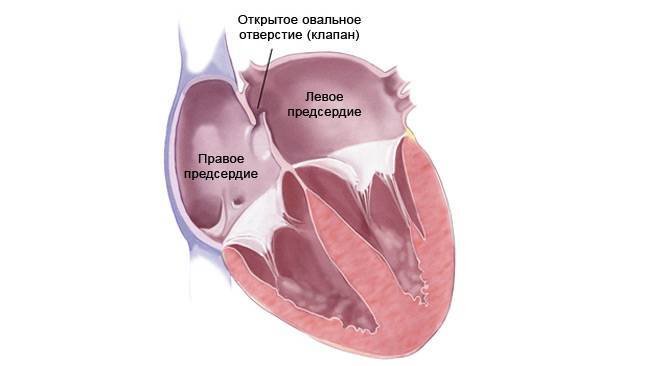
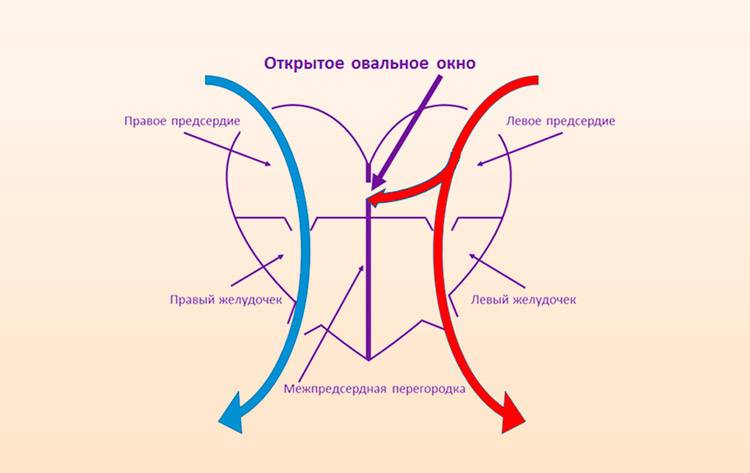
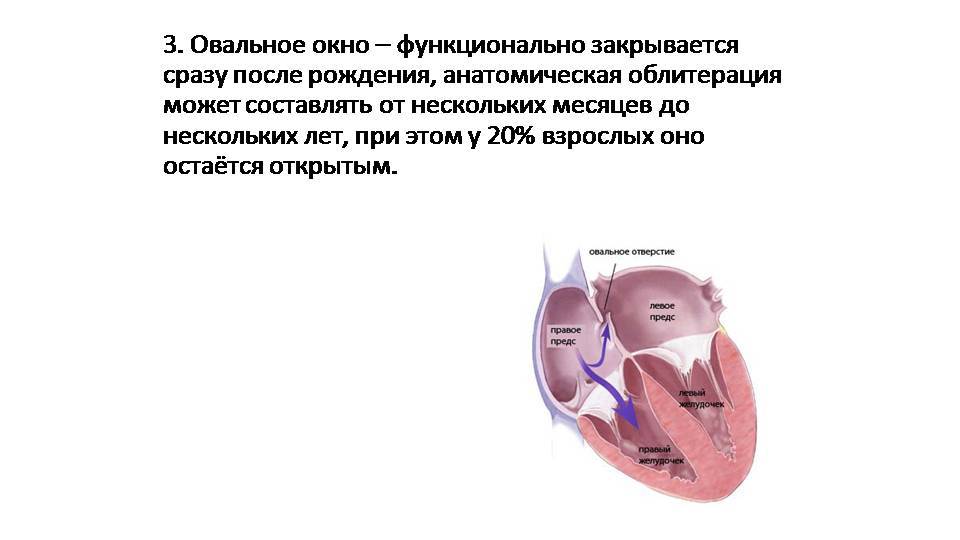
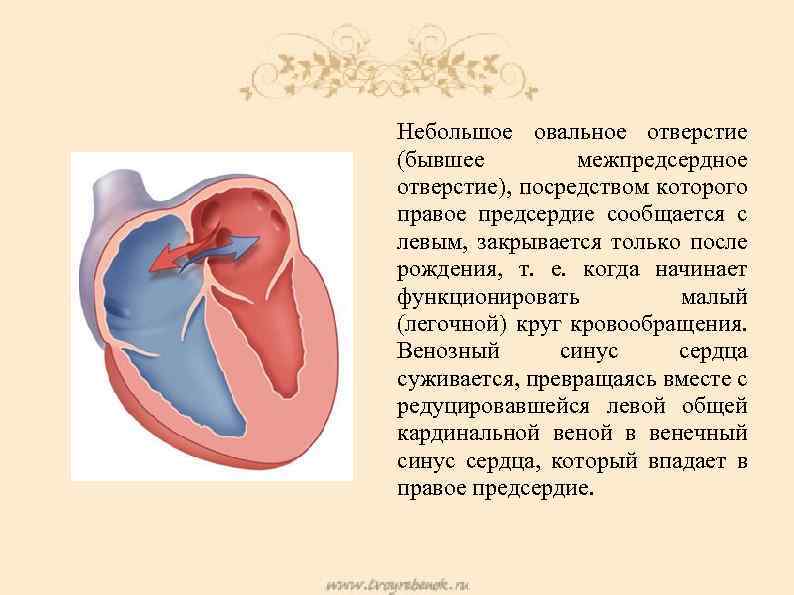
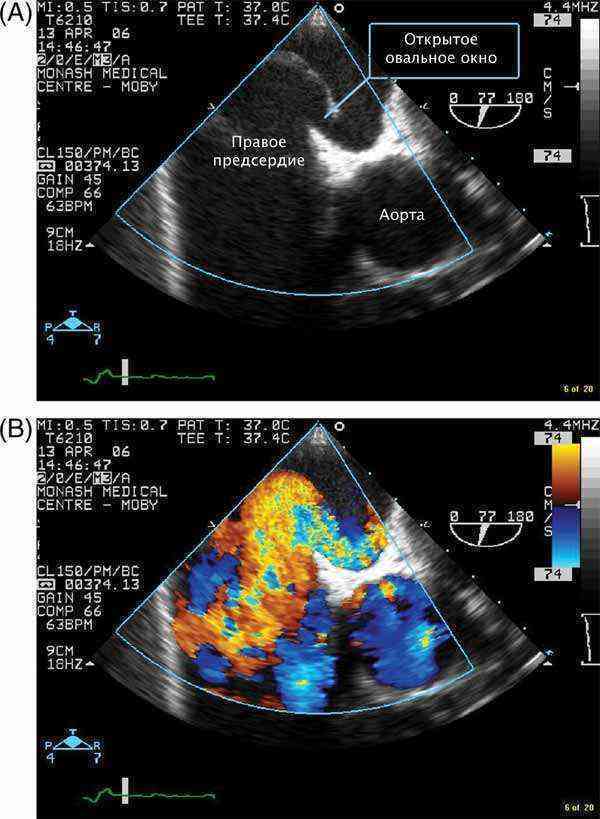
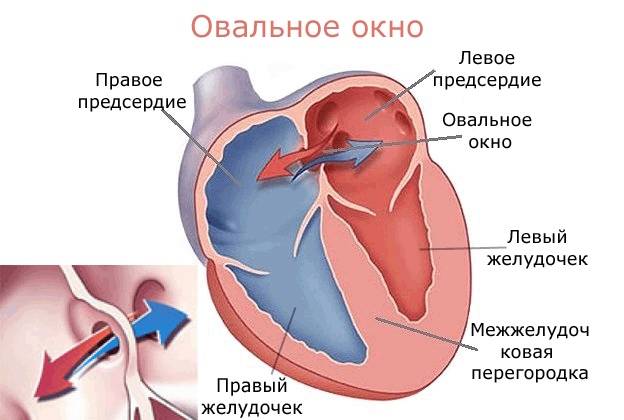
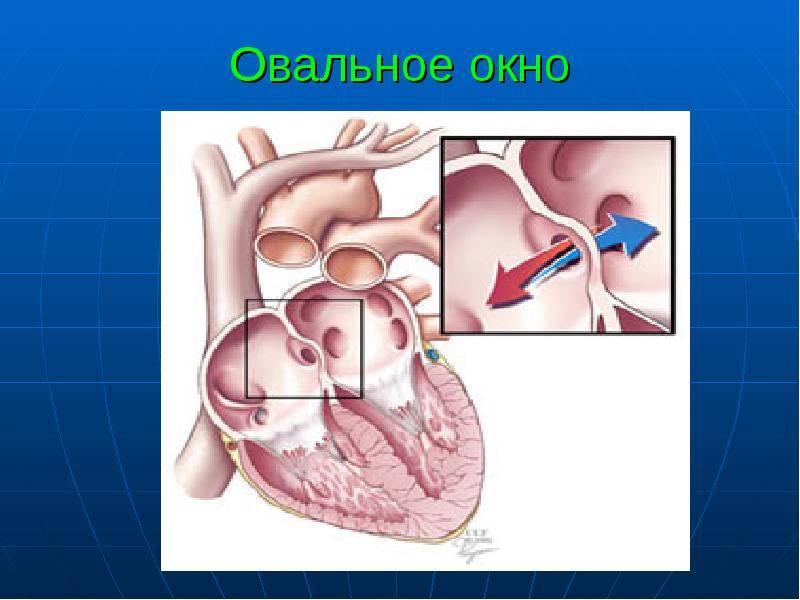
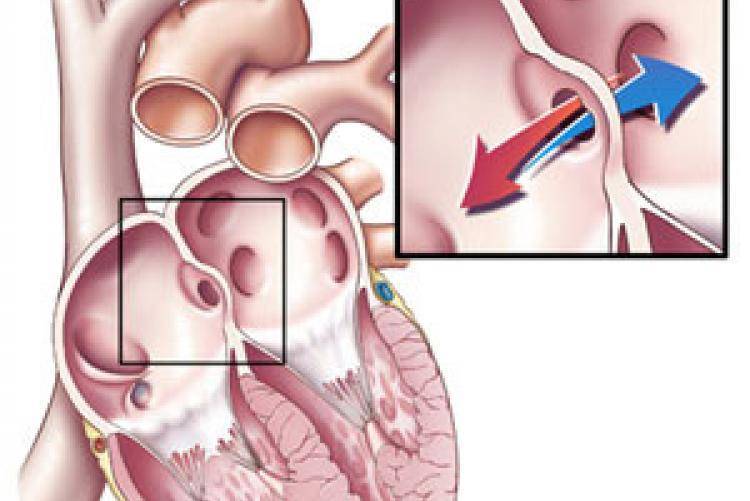
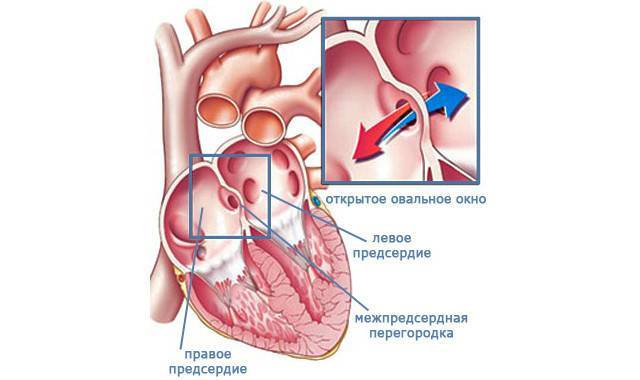
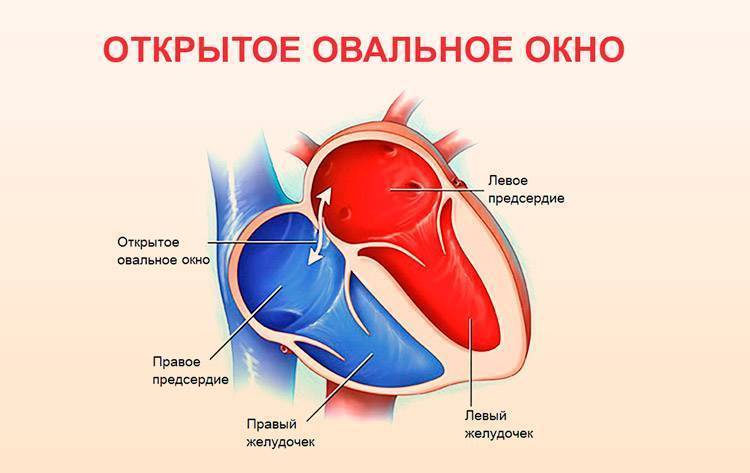
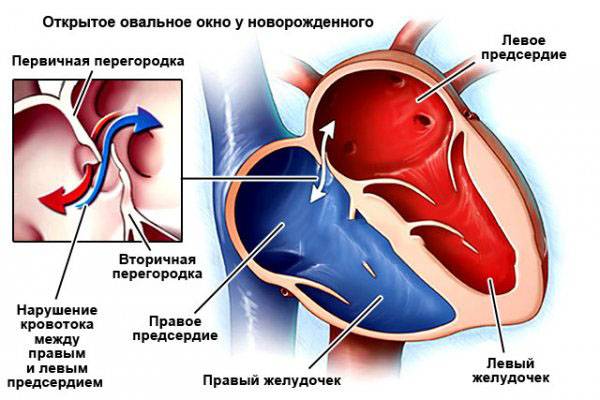
При наличии открытого овального окна в межсердечной перегородке тромбы из вен нижних конечностей, таза могут переместиться из правого предсердия в левое и далее с током крови попасть в мозг. В результате также наступает инсульт.
Тромбы, образующиеся при аневризме сердца
После перенесенного инфаркта в левом желудочке могут образоваться пристеночные тромбы. Их видят специалисты с помощью эхокардиографии. Это основной вид диагностики для обнаружения тромбов в полостях сердца. В случае их обнаружения специалист может назначить антикоагулянты (при отсутствии противопоказаний).
Тромбы, образующиеся при стенозе митрального клапана
Бывает особая разновидность — шаровидный тромб в левом предсердии. Такой тромб образуется при стенозе митрального клапана, при котором нарушается отток из левого предсердия в левый желудочек.
При мерцательной аритмии тромбы обычно локализуются в ушках левых предсердий. Ушко представляет собой выпячивание предсердия (оно похоже на мешочек). Тромбы ушка левого предсердия можно выявить чаще всего только при чреспищеводной Эхо-КГ. С помощью эхокардиографии их обнаружить очень трудно.
Преимущества эндоваскулярной методики
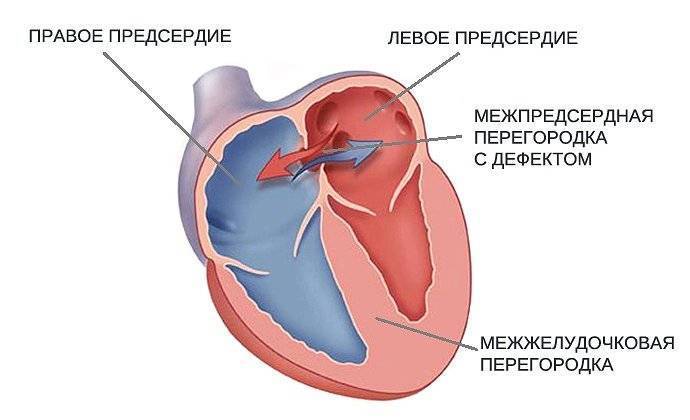
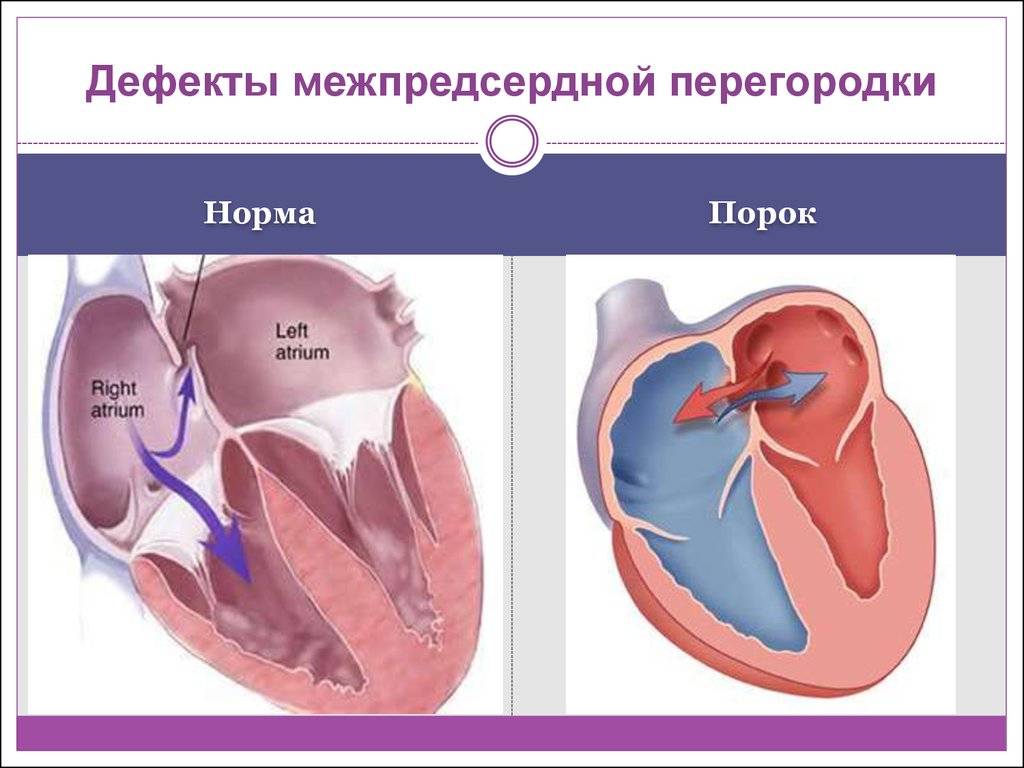
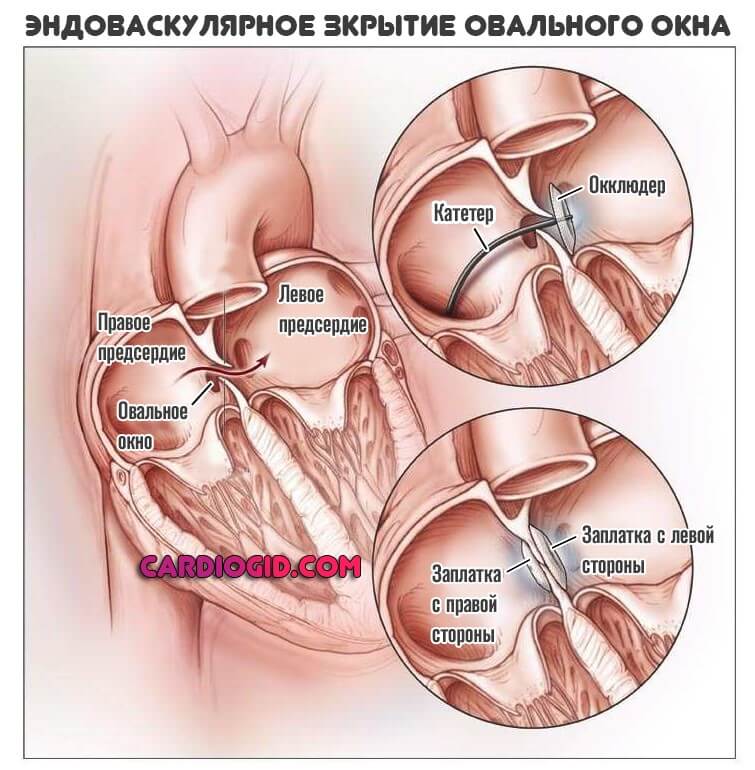
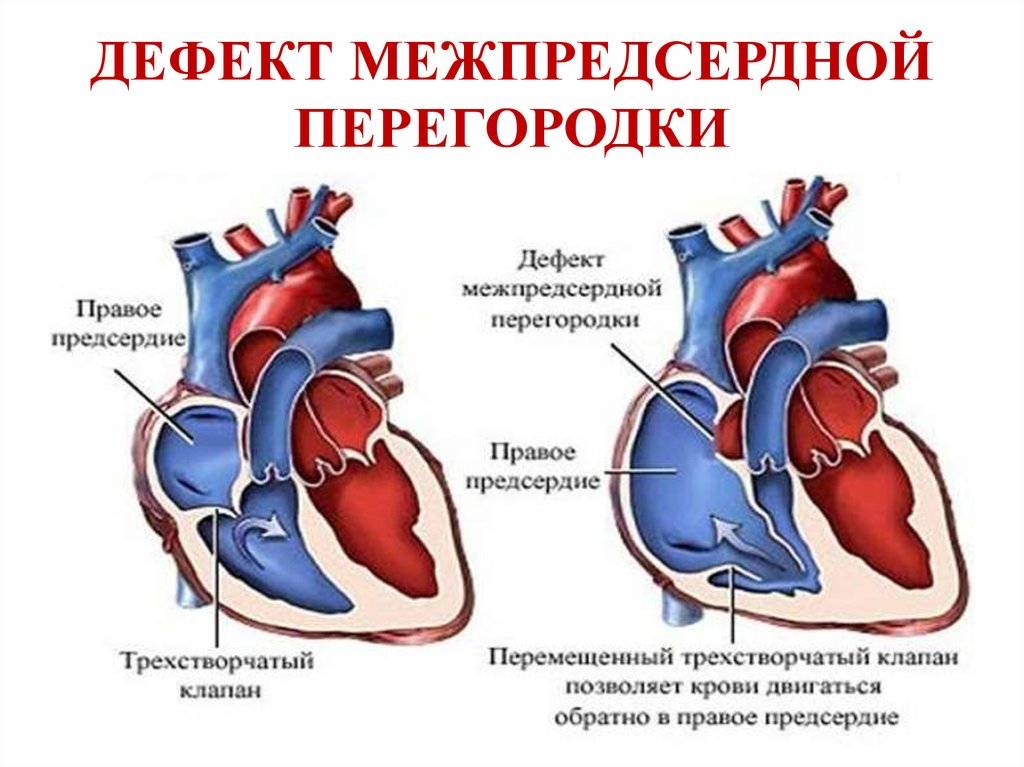
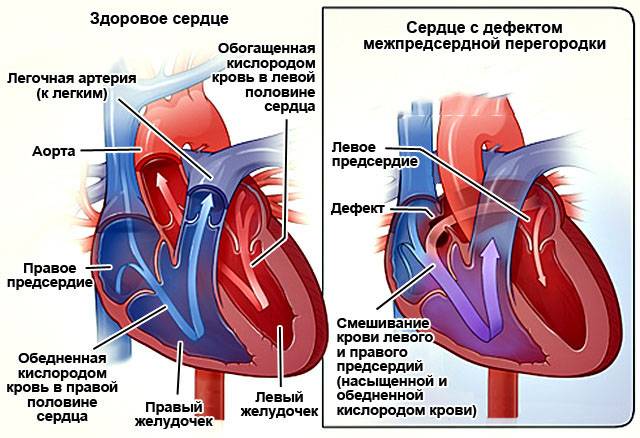
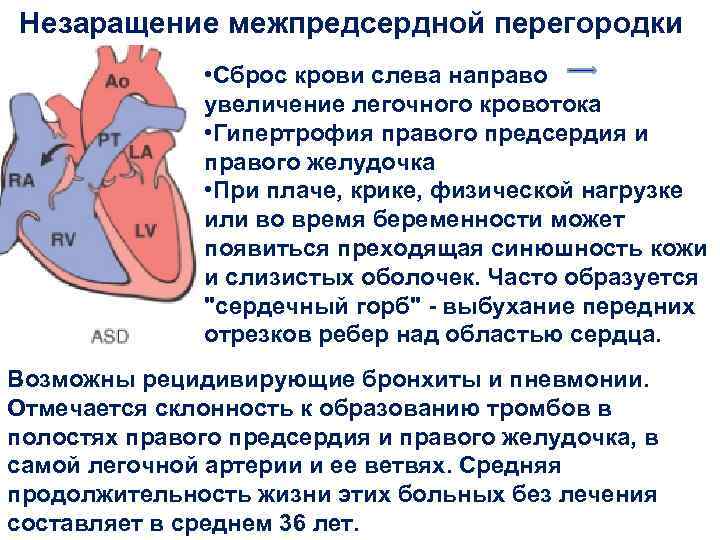
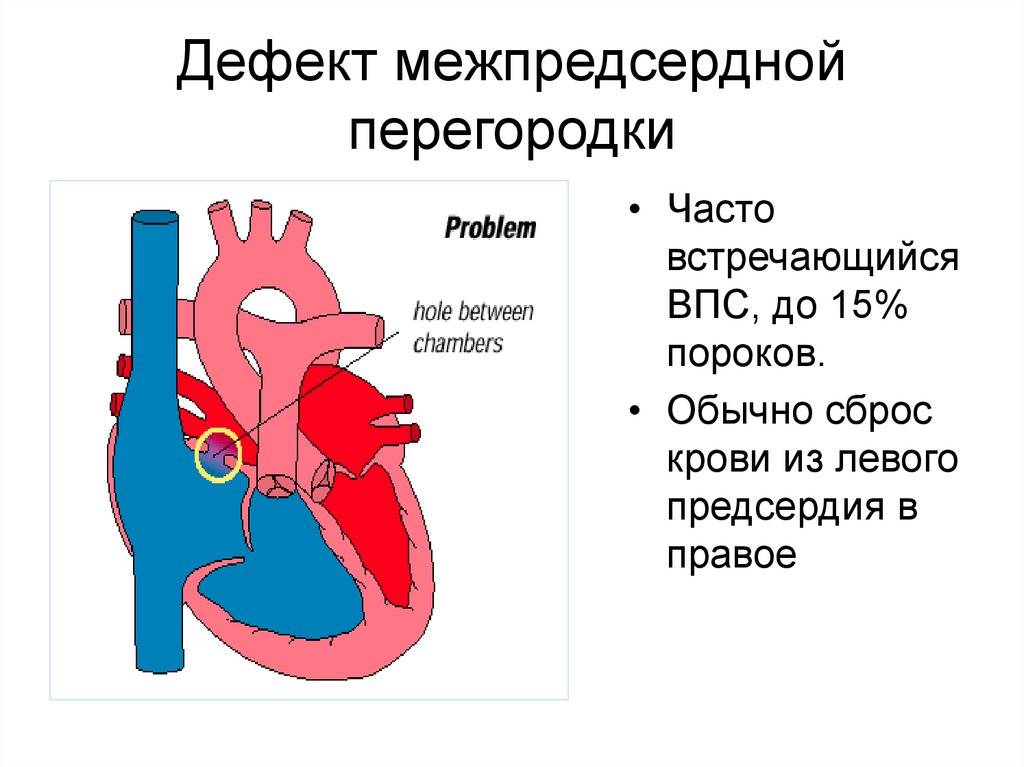
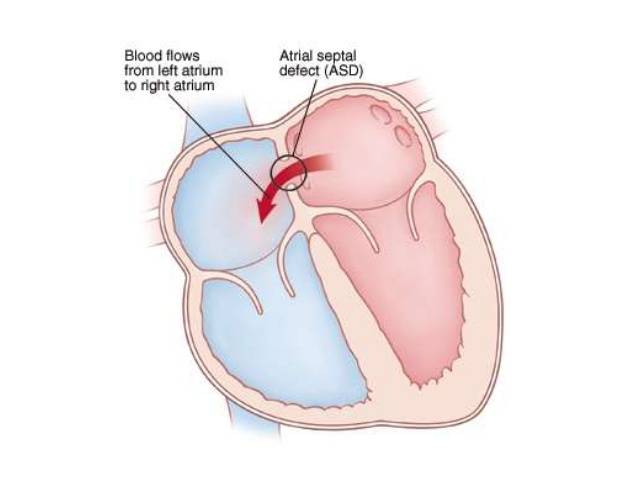
Эндоваскулярный способ закрытия дефекта выгодно отличается от операции по ушиванию ДМПП. Последняя требует искусственного поддержания кровообращения во время операции, имеет больше противопоказаний и значительный период реабилитации. Несмотря на то, что хирургическое лечение прочно вошло в практику и применялось долгое время, сейчас оно уступает место эндоваскулярному методу.
Главное преимущество в том, что эндоваскулярная операция – это малоинвазивная хирургия. После нее не остается шрамов, процедура не требует разрезов или открытого доступа. У эндоваскулярного метода чрезвычайно низкий процент послеоперационных осложнений. Пациентам не требуется длительная госпитализация и реабилитация.
На данный момент эндоваскулярная операция – это общепризнанный мировой стандарт, отвечающий всем требованиями безопасности и эффективности.
Принцип работы окклюдера
Впервые операция с помощью окклюдера была произведена в конце 80-х годов прошлого века – это был эксперимент на животных. Окклюдер – это специальное устройство, которое устанавливают через сосудистый доступ, а после установки оно выполняет функцию заплатки. Со временем техника выполнения таких операций совершенствовалась, и сейчас успешно применяется для лечения тысяч пациентов. Уже в 21 веке появилось множество модификаций и разновидностей окклюдеров для разных случаев.
Принцип работы устройства следующий: конструкция, раскрывающаяся подобно зонтику, заводится в нужное место через сосуд. После установки заплатки никаких других манипуляций не требуется. Окклюдер производят из сплавов металлов, давно применяемых в медицине – из никеля и титана, покрытых сверху специальным биосовместимым волокном. Материалы протестированы множество раз, они не вызывают аллергии. Устройство сконструировано таким образом, что центровка в отверстии перегородки происходит самостоятельно – задача врача довести окклюдер по сосудам до нужного места. Модель устройства подбирается в зависимости от конкретного дефекта – существуют разные модификации для лечения разных пороков сердца.
Доставка к сердцу производится с помощью катетера, который заводят в крупный сосуд – артерию или вену бедра. Размер окклюдера не больше 2,5 мм в диаметре, поэтому он спокойно проходит по сосудистому руслу. Устройство раскрывается только после установки в соответствующее положение рядом с дефектом перегородки.
Операция выполняется квалифицированными врачами, прошедшими специальное обучение. Процедура проводится в операционной. Пациент во время операции лежит. Врач может контролировать все свои действия с помощью специального оборудования, передающего изображение на мониторы. В ходе операции проводится мониторинг жизненных показателей.
Читать полностью
Врачи, выполняющие эндоваскулярное закрытие дефекта межпредсердной перегородки
Бабунашвили Автандил Михайлович
Врач сердечно-сосудистый хирург, заведующий отделением сердечно-сосудистой хирургии, доктор медицинских наук, профессор, заслуженный врач РФ
Стаж 34 года
Записаться на прием
Причины брадикардии
Урежение сердечного ритма может возникать не только при поражениях сердца, но и при внесердечных патологиях. Среди распространенных причин уменьшения ЧСС:
- ишемическая болезнь сердца, пороки сердца, атеросклеротический кардиосклероз, инфаркт, миокардиты, кардиомиопатии, перикардит;
- желтуха и почечная недостаточность, при которых токсины замедляют выработку импульсов сердечных сокращений;
- болезни соединительной ткани (ревматизм, ревматоидный артрит, склеродермия, красная волчанка);
- гипотиреоз — снижение функции щитовидной железы;
- инфекции (дифтерия, боррелиоз, сифилис, токсоплазмоз, вирусные гепатиты и прочее);
- нарушение электролитного состава крови — снижение уровня калия и повышение кальция;
- повышение внутричерепного давления при опухолях головного мозга, инсульте, травмах, пороках развития;
- лимфогранулематоз, миеломная болезнь, амилоидоз, саркоидоз, гемохроматоз — состояния, при которых возможно поражение миокарда.
Нередко возникают лекарственные брадикардии. Это происходит на фоне приема или при передозировке бета-блокаторов, сердечных гликозидов, блокаторов кальциевых каналов, антиаритмических средств.
- болезни нервной системы;
- патология ЖКТ (язвенная болезнь желудка и двенадцатиперстной кишки, холецистит, желчнокаменная болезнь);
- заболевания пищевода и диафрагмы;
- пониженная температура тела, переохлаждение;
- удар в верхнюю часть живота (вплоть до остановки сердца);
- надавливание на глазные яблоки или шею в зоне сонной артерии;
- кашель, рвота.
При урежении сердечного ритма артериальное давление (АД) может быть нормальным, повышенным и пониженным.
Брадикардия при высоком давлении — нечастое явление. Оно опасно остановкой дыхания, потерей сознания, риском тромбообразования, недостаточностью кровоснабжения мозга и сердца с развитием инсульта и инфаркта. Сочетание гипертонии и брадикардии требует особых подходов в лечении, чтобы не усугубить урежение ритма.
Для новорожденных (особенно недоношенных) брадикардия может возникать на фоне апноэ — остановки дыхания более чем на 20 секунд (рис. 2). Это происходит из-за незрелости нервной и мышечной ткани новорожденного.