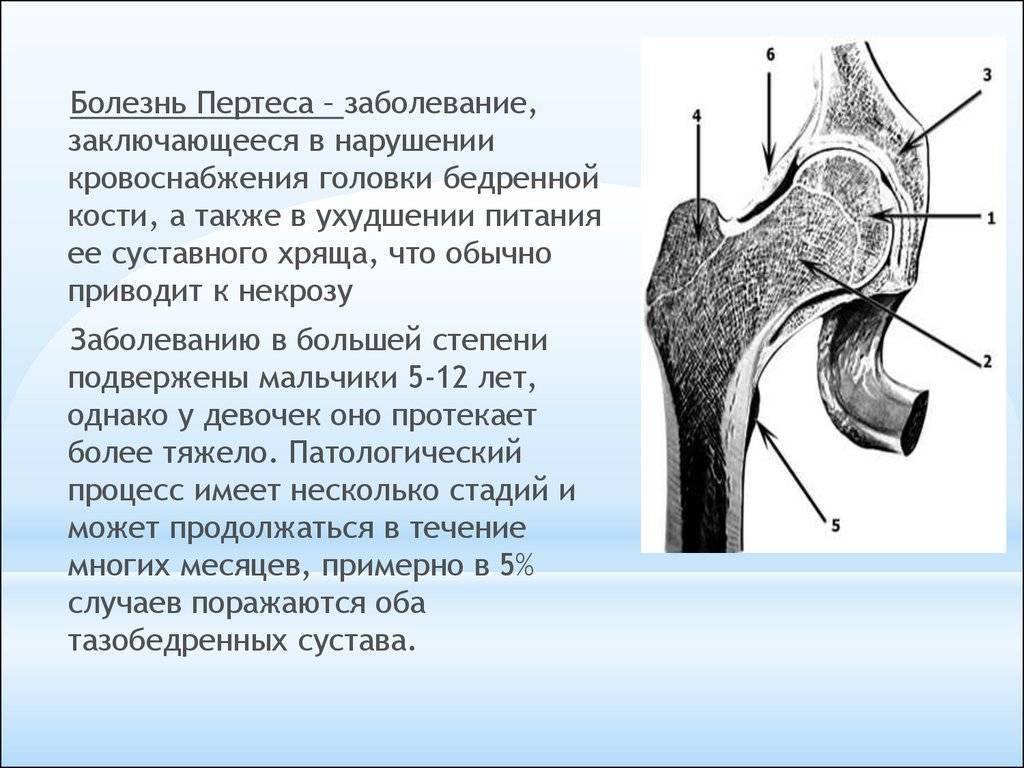
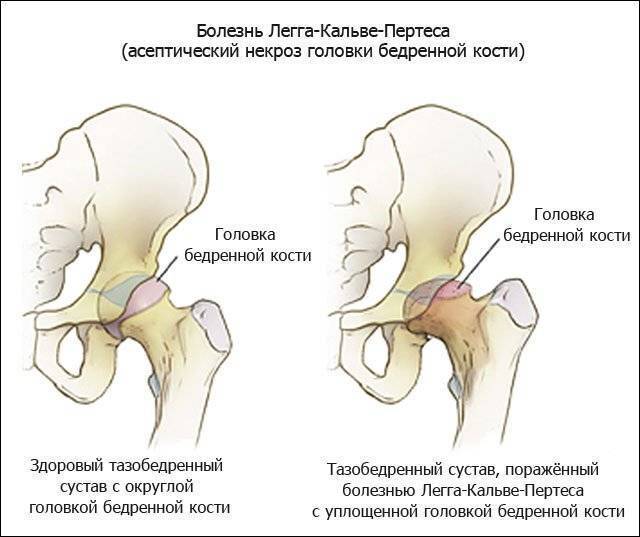
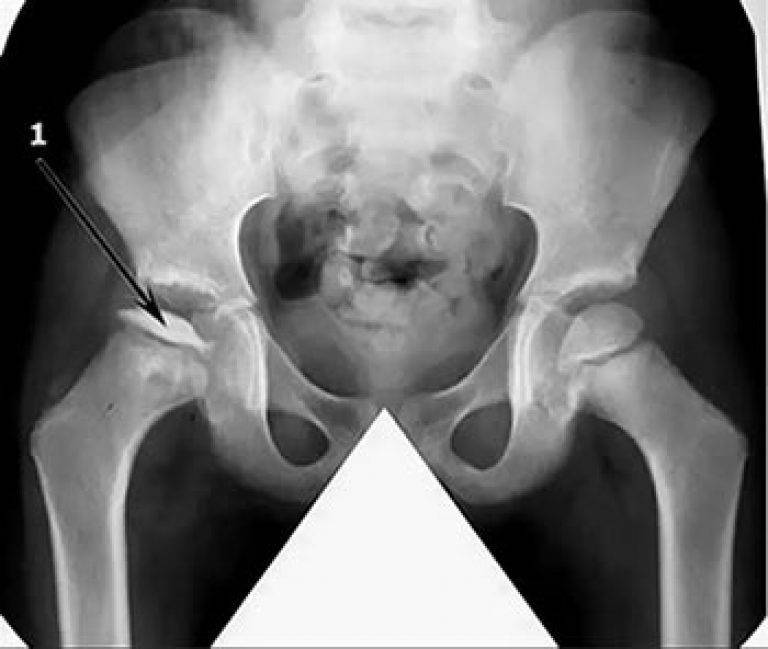
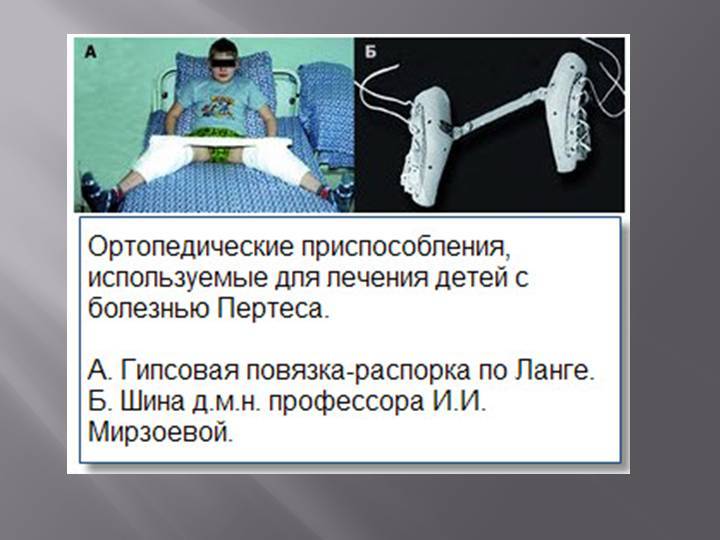
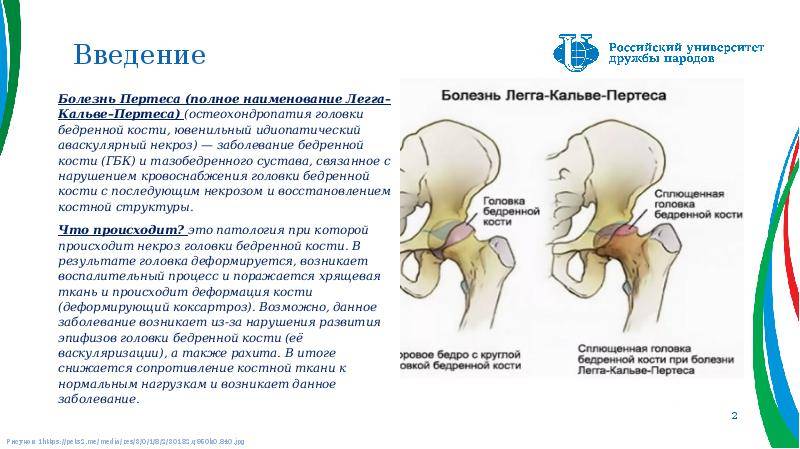
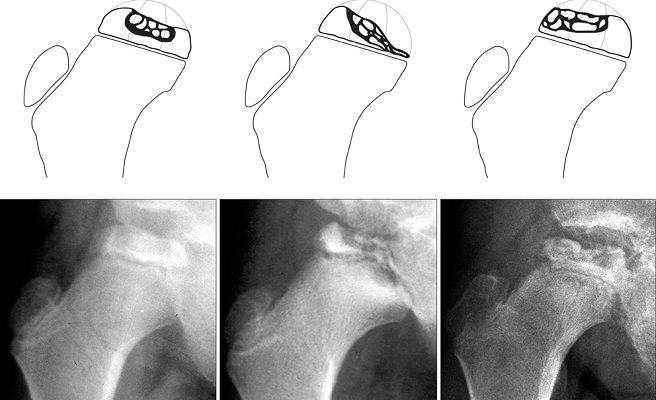
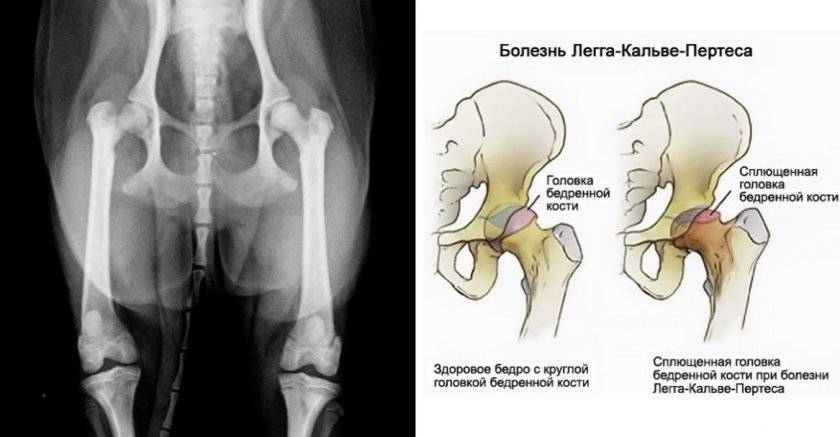
Симптомы
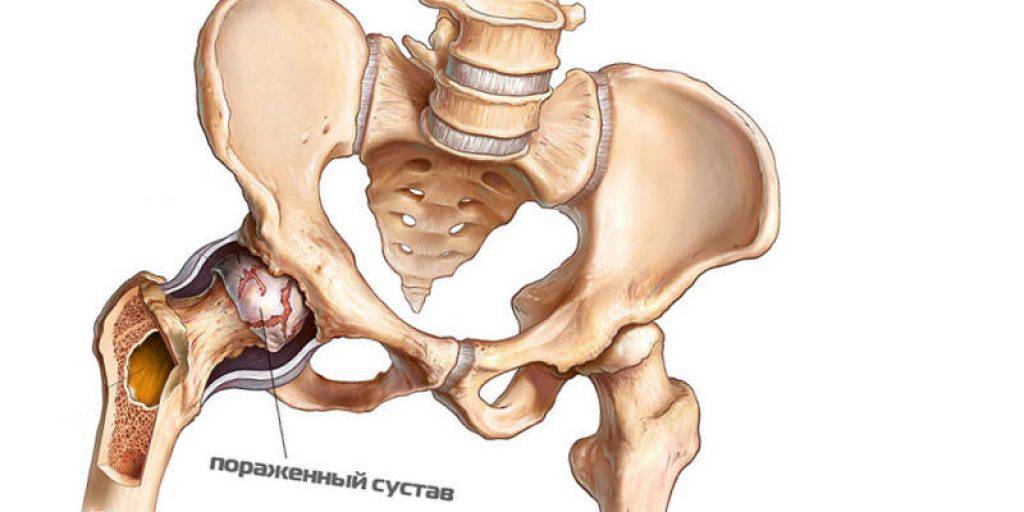
Симптоматика при болезни Пертеса зависит от степени некротизации и величины очага некроза. При начальной стадии болезни Пертеса симптомы могут отсутствовать или быть незначительными. Дети могут жаловаться на умеренные болевые ощущения в области бедра тазобедренного сустава или коленного сустава.
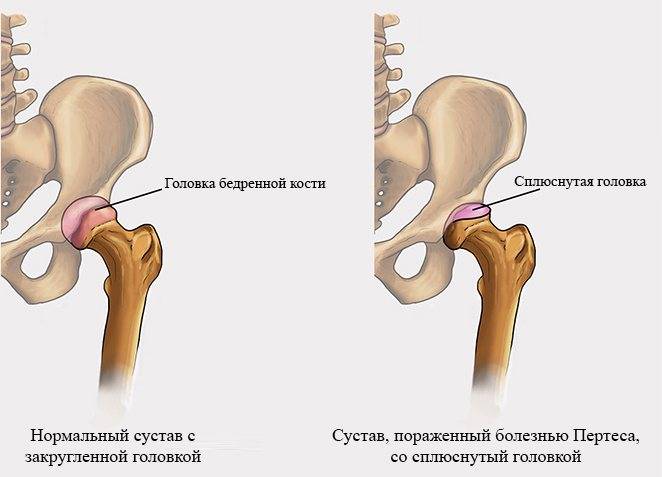
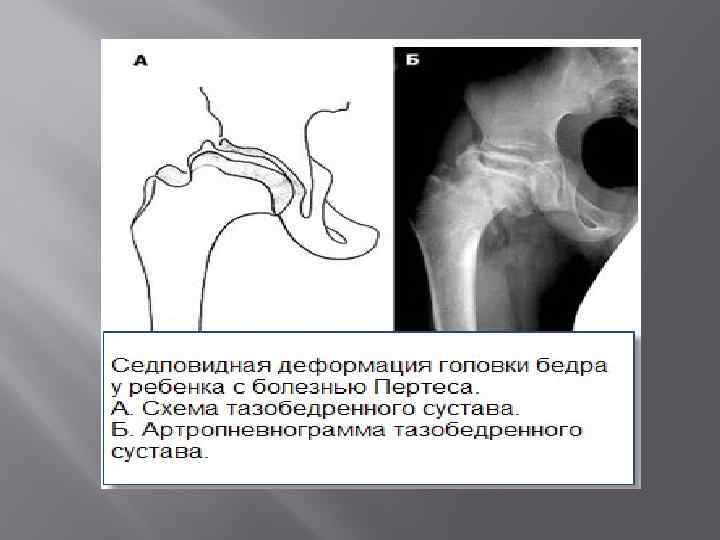
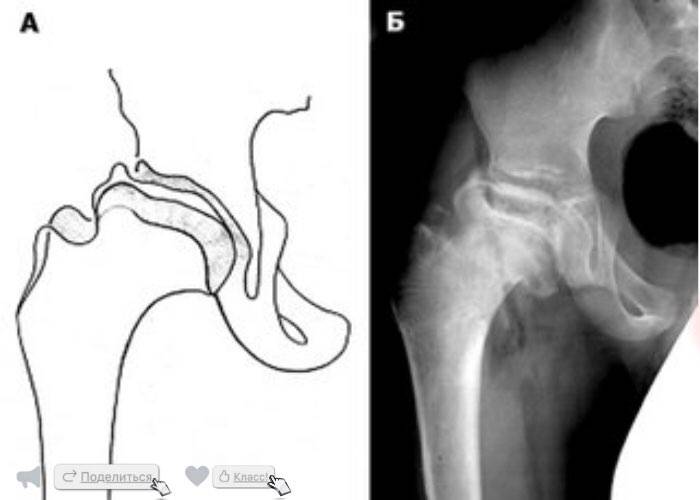
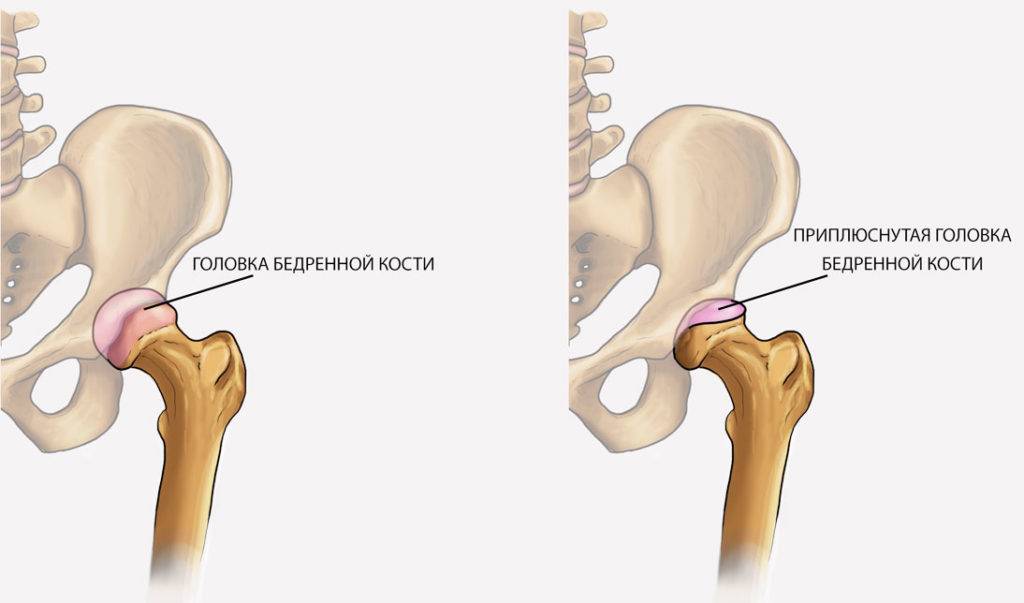
Кроме того, может отмечаться нарушение походки (приволакивание ноги). Такое латентное лечение при начальной стадии болезни Пертеса (стадия остеонекроза) приводит к тому, что диагностировать и соответственно лечить это заболевание на ранней стадии удается редко. По мере развития некроза развивается деформация головки бедра, что приводит к изменению биомеханики сустава и появлению таких симптомов, как хромота, боли в ноге, в суставе. Последствиями импрессионных переломов в зоне некроза может быть укорочение конечности, что возможно будет обнаружено при визуальном осмотре.
Как развивается заболевание
Синдром Ретта у детей – довольно коварное заболевание. При рождении оно практически не проявляет себя. Первые его симптомы появляются в период от 6 мес. до полутора лет. Однако некоторые, еле заметные признаки, в первом полугодии все-таки имеются. Но они настолько ничтожны, что не привлекают внимания.
Вот что говорит мама одной из девочек с синдромом по поводу первого полугодия ее жизни. Она придала значение этим мелочам только по прошествии 1 года и 7 месяцев с рождения ее дочери, когда проявления стали уже явными. Из предвестников болезни она отметила, что ее малышка начала держать голову в 3 месяца, а не в 2, как это положено. В 6 месяцев она еще не могла сидеть, а ходить начала только в 1 год и 4 месяца. Психологически развивалась нормально, и говорить начала рано, но это были не стандартные слова «мама», «папа», а «зайчик», «мишка» и др.
В 1 год и 7 мес. она перестала узнавать родителей и, казалось, не нуждалась в них. Весь день проводила за одним однообразным занятием: кидала мяч или катала коляску. Часами ходила по кругу, пока ее не останавливали или она запиналась. Такое стереотипное поведение носит название полевого, когда действие затягивает больного, и он не может ничего сделать.
В четыре года к симптомам присоединились эпилептоидные припадки. Однако по достижении школьного возраста девочка находилась на домашнем обучении, и делала некоторые успехи.
12–6 лет – это был период ремиссии, когда болезнь практически не беспокоила. Но с 16 лет появились новые, более глубокие проблемы, связанные с костными деформациями и болезнями внутренних органов. Одна нога девочки была короче другой почти на 10 см, что не могло не препятствовать ходьбе. В 20 лет она весила всего 24 кг с ростом 158 см.
Обычно СР протекает в 4 стадии.
Первая стадия, которая, как правило, стартует с 6 месяцев до полутора лет, проявляется нарастанием раздражительности и лабильностью настроения у ребенка. Эпизоды плача и психомоторного возбуждения сменяются все большей пассивностью. Малыш бесцельно передвигается по комнате, пропадает интерес к игрушкам. Но контакт с матерью сохраняется.
Вот как описывает женщина поведение своей дочери на заре заболевания: она кричала целый день без остановки, билась головой о стены, не могла уснуть. Что бы мы ни делали, она не успокаивалась. Это был настоящий ад. Но больше угнетало то, что ни один врач не мог поставить вразумительный диагноз.
Развивается диспропорция головы и конечностей по отношению к телу. Они становятся несоизмеримо маленькими. Замедляется рост, и снижается тонус мышц.
Вторая стадия, длящаяся несколько лет, отличается пестротой симптомов
Сразу обращает на себя внимание снижение интеллектуальных способностей, развивается умственное слабоумие. Происходит регресс практически всех полученных навыков
Речь полностью исчезает или переходит в степень эхолалии – механического повторения услышанного.
Приобретенные двигательные навыки, предметно-ролевое поведение теряются и замещаются двигательными стереотипами. Характерный симптом: многочисленно повторяющиеся движения, напоминающие мытье рук. Кроме этого, ребенок постоянно заламывает или потирает их, размахивает ими, хлопает в ладоши. Сжатие пальцев рук вполне нормально в 4 месяца, но в более позднем возрасте говорит об остановке развития. Малыш утрачивает хватательный рефлекс, не способен производить вращательные движения руками.
Постепенно двигательная активность сходит на нет. Нарушается походка, ребенок ходит, не сгибая коленей.
Третья стадия длится 10 лет и более, характеризуется она развитием стойкого, глубокого слабоумия, вплоть до идиотии. Наблюдается полная потеря способности говорить и понимать обращенную к ребенку речь. Появляется тремор всего тела, отягчающий движения. Усиливаются судорожные припадки.
Четвертая, конечная стадия – это период усугубления ранее проявляемых симптомов. Стойкая утрата умственных способностей, двигательных навыков, развитие мышечных дистрофий, приводящих к полному обездвиживанию.
Продолжительность жизни таких больных в среднем колеблется до 30 лет, хотя известны случаи, когда они доживали и до 50-летнего возраста.
Лечение запора
Ребенку не сходить в туалет – начинаем диагностику и лечение заболевания.
Лечение запоров у детей начинают с выяснения причины, создания благоприятной семейной обстановки, использования похвалы ребенка при маленьких победах.
Обязательным в лечение запоров у новорожденных является диетотерапия мамы, которая кормит грудью, а так же рационального использования адаптированных молочных смесей. Каждая задержка стула должна направить родителей и ребенка на лечение. Запор у грудничка может являться следствием другого хирургического заболевания.
Все средства применять с осторожностью предварительно прочитав инструкцию по применению!
Нарушенное отхождение кала является основой для назначения препаратов с лактобактериями или питательными веществами для их размножения, например Дюфалак, у ребенка. Запор связан с нарушенной моторикой кишечника, поэтому рационально назначения прокинетиков. Широко применяются методы физиотерапии.
Итак, если у ребенка запор, то это повод для обращения за специализированной медицинской помощью. Лечение запоров у новорожденных нужно начинать с контроля питания, как мамы, так и ребенка. Опасным является запор у новорожденного.
Лечение Назначает только врач!
Методы физиотерапии современный подход при нарушении отхождении стула
Запор у новорожденного — лечение важно начинать с безболезненных методов, которые должны быть высокоэффективными.
Какой стул считается нормальным?
Если у ребенка запор, то нужно обратить внимание на характер испражнений, частоту, наличие болей при акте дефекации, патологических примесей (крови, гноя, слизи) в кале. Новорожденный ребенок испражняется часто, но малыми порциями, примерно 1 столовая ложка кала за акт дефекации
Новорожденный ребенок испражняется часто, но малыми порциями, примерно 1 столовая ложка кала за акт дефекации.
Сам стул должен быть кашицеобразным, переваренным, с характерным запахом кала (в зависимости от вида кормления), переваренный без слизи, крови, гноя. В 2 года стул должен быть оформленным или «колбаской», характерного цвета и запаха (в зависимости от продуктов питания). Сам акт дефекации должен быть безболезненным.
Если у ребенка запор, то стул становится твердым или даже «овечьим» (маленькими комочками), редким (менее 1 раза в 3 дня), при акте дефекации появляется боль, иногда могут быть полоски крови на кале (трещины слизистой оболочки прямой кишки). «У ребенка запор что делать?» – немедленное обращение за медицинской помощью.
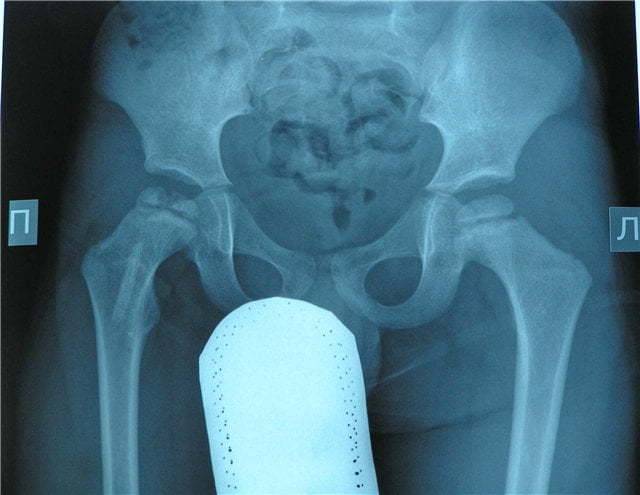
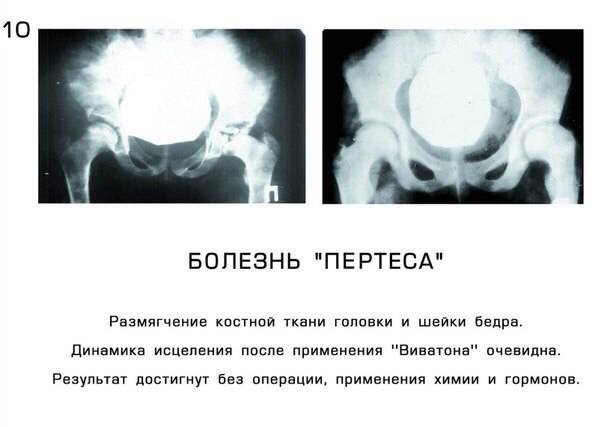
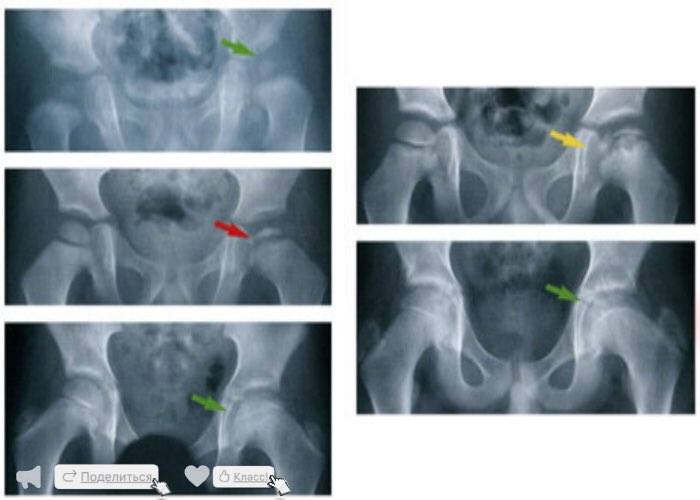
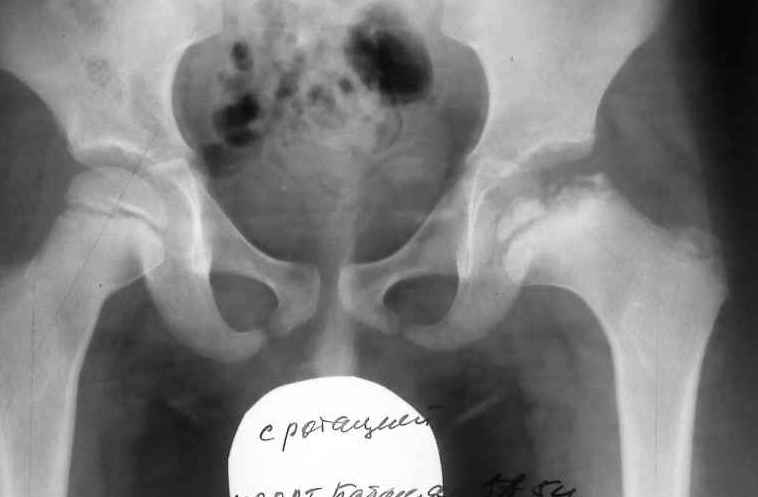
Как протекает болезнь Пертеса?
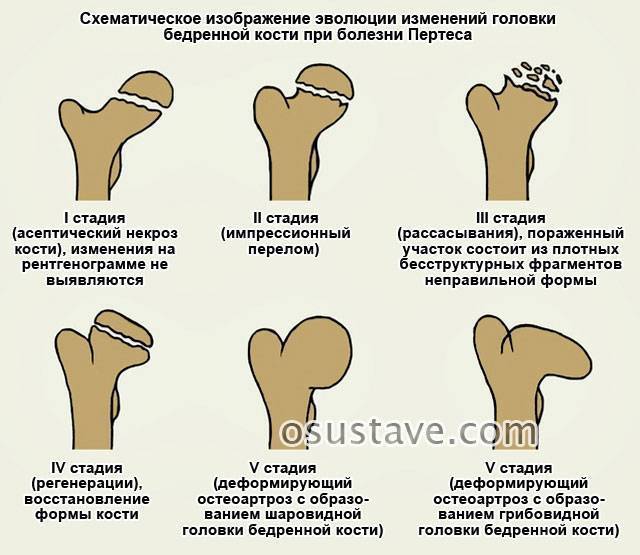
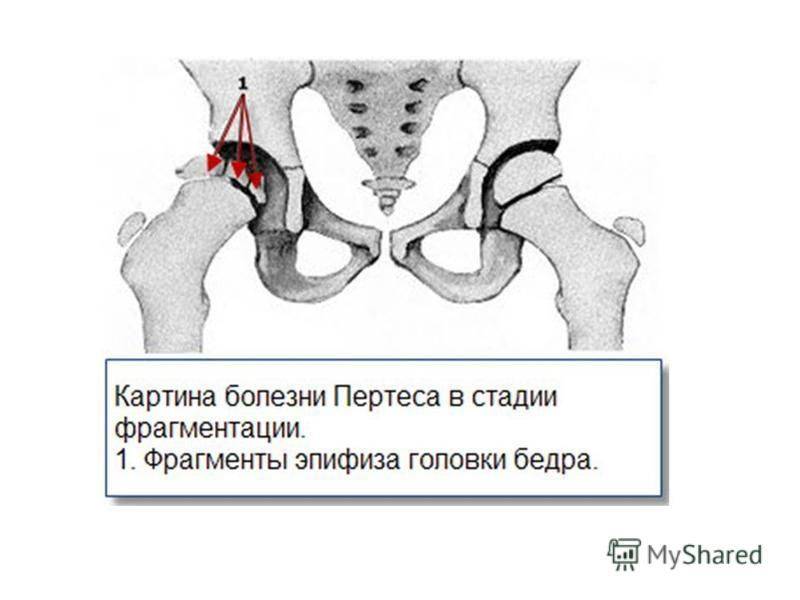
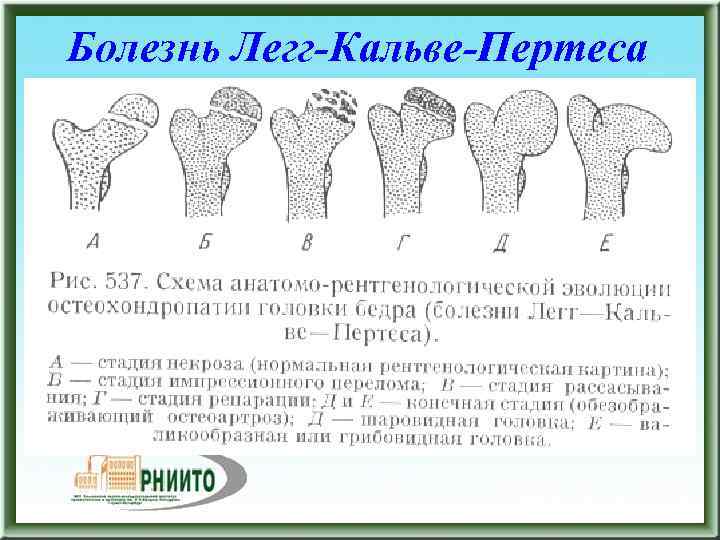
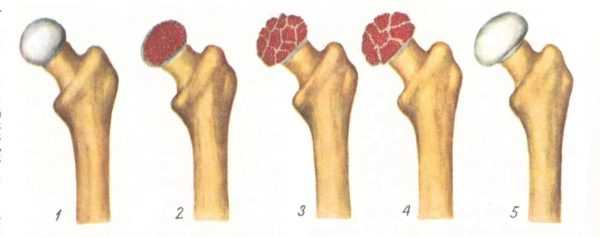
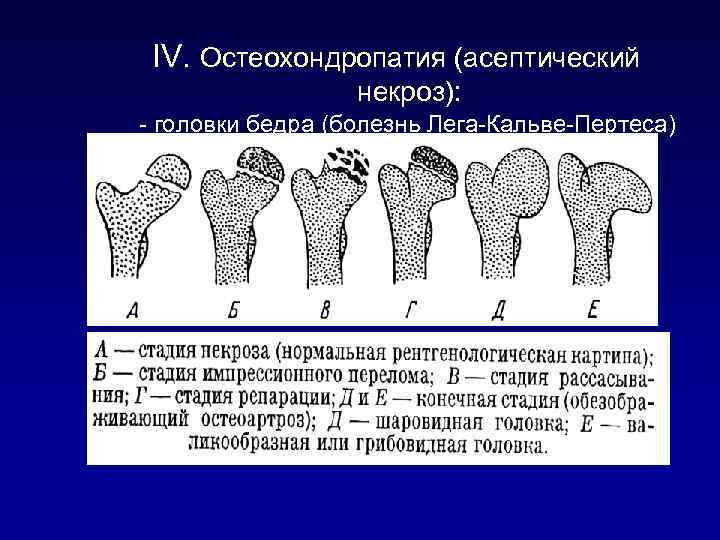
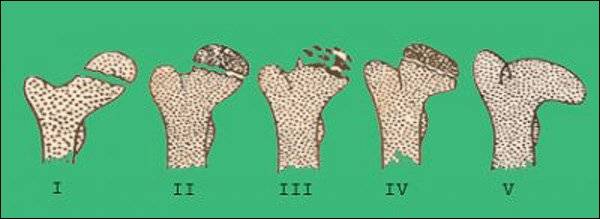
В клиническом течении болезни Пертеса различают пять последовательных, сменяющих друг друга стадий:
-
I стадия — развивается некроз ядра окостенения головки бедренной кости;
-
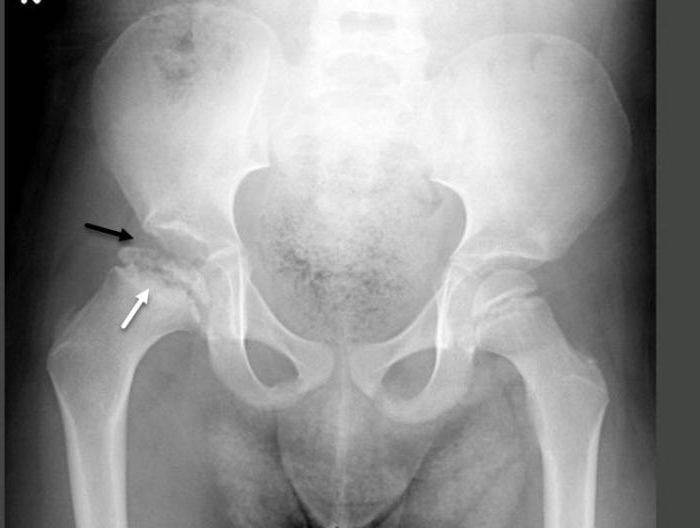
II стадия — из-за нарушения структуры и плотности головки бедренной кости возникает её вторичный компрессионно-импрессионный перелом;
-
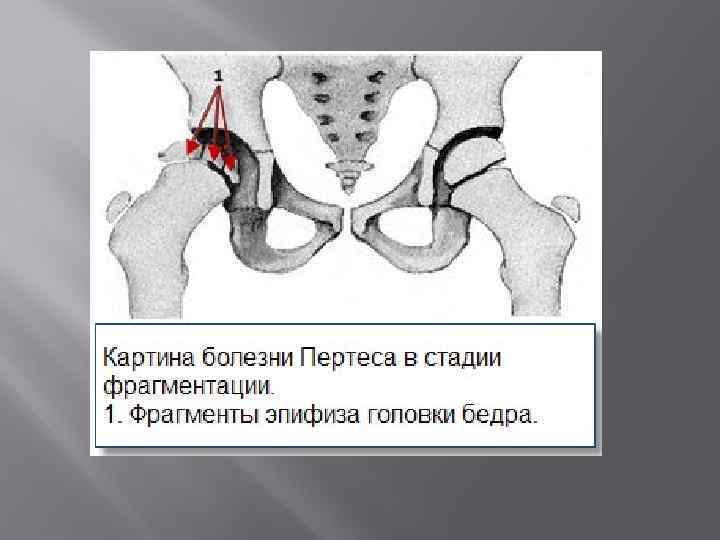
III стадия — происходит рассасывание некротизированной костной ткани и её фрагментация, укорочение шейки бедренной кости;
-
IV стадия — происходит разрастание соединительной ткани вместо пораженных костно-хрящевых структур;
-
V стадия — происходит окостенение замещающих соединительнотканных структур за счет отложения кальция с образованием костной ткани.
Запор у грудного ребенка
Основной причиной запора у грудного ребенка является неправильное введение прикорма.
Злоупотребление растительной клетчаткой, например введение детского питания с основным содержанием капусты, брокколи, свеклы. Употребление неразведенного гранатового сока, который обладает свойством дубления.
Если новорожденному не сходить в туалет, то причина кроется в маме, которая кормит ребенка грудью. Употребление крепкого чая, кофе, белого хлеба, большого количества свежих овощей приводит к тому, что грудничку не сходить в туалет. Органическими причинами запоров можно считать анатомические дефекты, например болезнь Гиршпрунга, опухоли лимфатического аппарата абдоминального отдела, полипы примой кишки, спаечная болезнь после операций, непроходимость кишечника или его инвагинация.
Истоки заболевания
В масштабном формате о расстройстве заговорили в 1983 году благодаря шведскому ученому Бенгту Хагбергу. В это время он со своей группой изучал 35 подобных между собой случаев в 3 разных странах: в Португалии, Франции и Швеции.
Однако Хагберт не является первооткрывателем синдрома. Впервые его обнаружил педиатр Андреас Ретт, имя которого носит заболевание. Он наблюдал за двумя девочками, имеющими одинаковые симптомы. Их он заметил в очереди на прием. Они сидели на коленях у матерей, а те держали их за руки. Девочки раскачивались как маятники, а затем внезапно обе начали совершать стереотипные движения руками. Дети застыли в одном положении, отстраненные от окружающего мира. Взгляд был направлен в одну точку. Поражала их синхронность в движениях и поведении.
В своих письменных архивах врач отыскал подобные истории болезни, а затем отправился в Европу, чтобы разыскать и там таких же пациентов. В 1966 он сделал первые публикации своих исследований, которые, однако, не вызвали особого интереса.
Зафиксированную им болезнь Ретт назвал синдромом атрофии мозга. Сначала ее считали проявлением аутизма или шизофрении, и только лишь в 1983 году вывели в отдельную нозологическую единицу.
В настоящее время синдром относят к категории довольно редких генетических заболеваний. Он встречается с частотой случаев 1 на 15000. Причиной его называют мутацию гена МЕСР2. Этот ген отвечает за синтез определенного белка, влияющего на развитие мозга. В норме этот белок, спустя некоторое время после рождения, должен подавляться другими генами, чтобы обеспечить нормальное развитие мозга.
Если же ген МЕСР2 мутирован, то белок инактивируется не полностью, что вызывает аномальное мозговое созревание, и провоцирует развитие синдрома Ретта.
Обычно мутирующий ген располагается в Х хромосоме, потому заболеванием страдают преимущественно девочки.
Запор у ребенка
Запор является заболеванием, которое наиболее часто встречается у ребенка.
Запор занимает одно из ведущих мест в педиатрической практике.

Существуют определенные нормы частоты стула, например, у детей первых месс жизни стул должен быть от 10-12 раз в сутки при грудном вскармливании и 2-3 раза на искусственном кормлении.
Запоры у ребенка 2 года жизни связаны со стрессами, походами в дошкольные учреждения, стеснительностью сходить в туалет.
В норме у детей данного возраста стул должен быть 6 -7 раз в неделю, а в старшем возрасте (после 2-3 лет) 3-4 раз в неделю. Могут быть запоры у месячных детей.Связано это с питанием мамы (употребление большого количествакрепкого чая, гранатового сока, белого хлеба и др. продуктов питания) при грудном вскармливании, а при искусственном перекорм ребенка, нарушение в работы кишечника как функционального, так и органического характера.
МАТЕРИАЛЫ И МЕТОДЫ
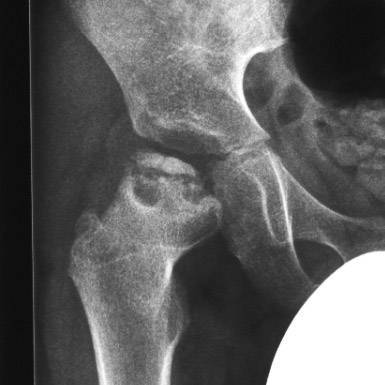
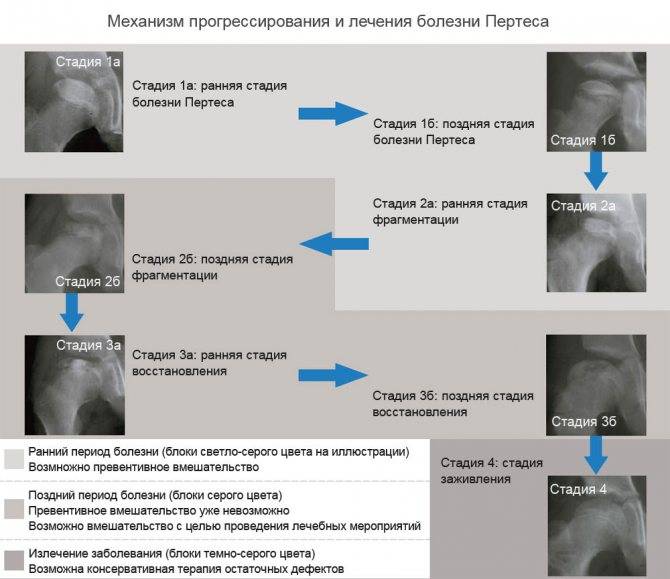
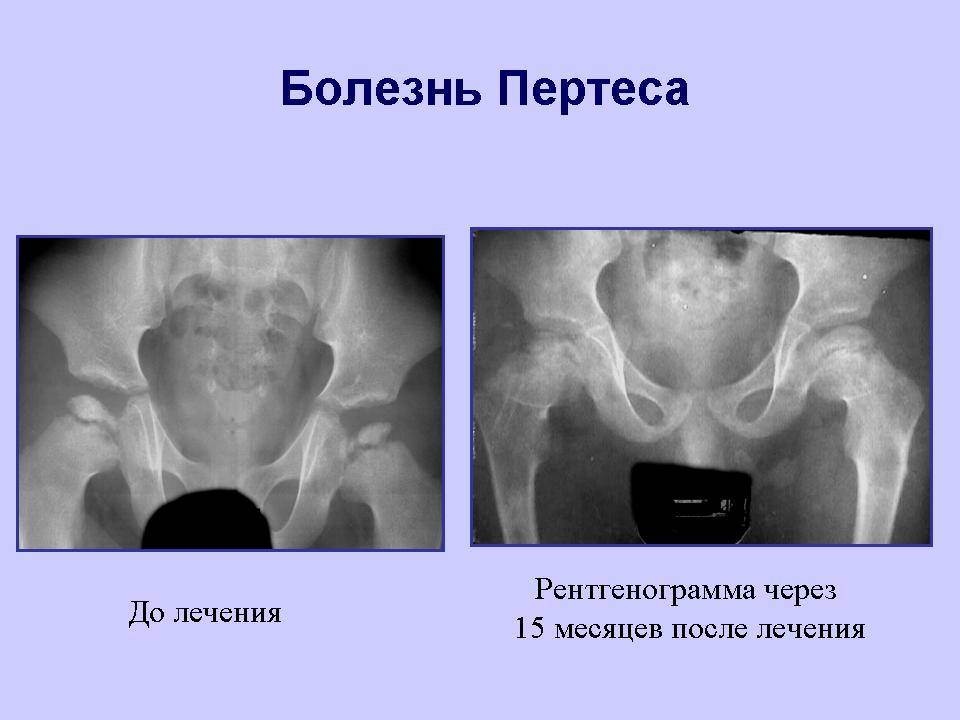
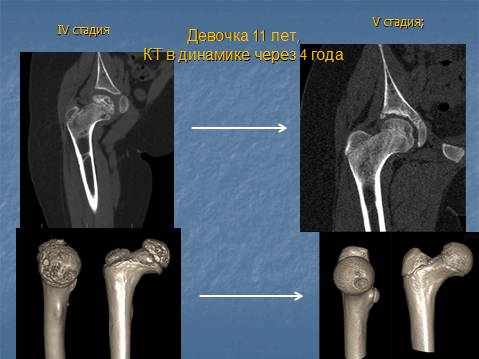
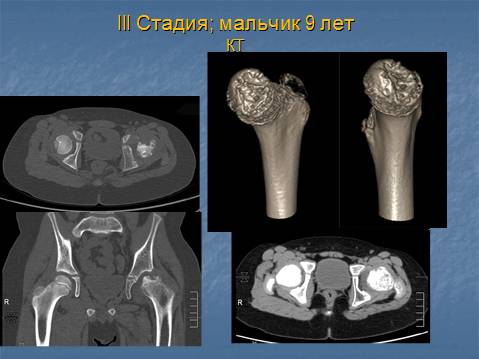
Изучены результаты лечения 16 детей с болезнью Пертеса в стадии фрагментации. Средний возраст при выполнении операции 7 лет 4 месяца (6-9 лет). 12
Рентгенологические признаки патологии. Средний показатель эпифизарного индекса был 0,24 (0,18-0,34). Средний показатель латерального смещения составил 0,3 (0,25-0,4). Прерывистость линии Шентона составляла 0,5,0-1,0 см. В 7 наблюдениях поражение головки сочеталось с увеличением шеечно-диафизарного угла до 145-150°. Величина угла антеверсии не превышала 30°.
Распределение суставов по критериям Catterall:IIIгруппа – 9, IV группа – 7. Распределение суставов по критериям Herring: группа В/С – 10, группа С – 6. Во всех наблюдениях рентгенологическая картина соответствовала IV (в) стадии по классификации Веселовского.
Технология включала спицевую туннелизацию суставных компонентов; введение через сформированные каналы в эпифиз и в субэпифизарные отделы шейки 2-3 мл клеточно-тканевой суспензии, полученной из костномозговой полости пациента. Затем производили центрацию головки бедра во впадине, межвертельную деторсионно — варизирующую остеотомию бедра. Шеечно-диафизарный угол уменьшали до 110°. Величина деторсии не превышала 10-15°.
Костные фрагменты фиксировали спице-стержневым аппаратом. Для последующей фиксации и декомпрессии сочленения в центрированном положении применяли модифицированный модуль аппарата Илизарова (9 наблюдений) или аппарат «Фиксарт» (7 наблюдений). Тазовые опоры фиксировали к кости с помощью 2-3 стержней и 2 консольных спиц, установленных в крыло подвздошной кости и надвертлужную область. В вертельную область вводили два стержня, которые фиксировали в секторе дуги. В дистальный метафиз бедра проводили по 3-4спицы, которые закрепляли и натягивали в кольцевой опоре. Аппараты применяли в неартикулирующем режиме. Один раз в неделю производили дистракцию 1-2 мм. Степень декомпрессии тазобедренного сустава определяли по величине обратного прерывания линии Шентона, которое должно составлять 0,5 см.
Пациенты начинали ходить с постепенно возрастающей нагрузкой с первого дня после операции. Болевой синдром был не выраженным. Пациенты адаптировались к аппарату в течение 5-7 дней.
Осложнения в виде поверхностного воспаления мягких тканей в области спиц I степени (по классификации Paley) отмечено в трех наблюдениях. Продолжительность лечения в аппарате была 80-90 дней.
После снятия аппарата дополнительную иммобилизацию не использовали. Проводился курс консервативного лечения. Постепенно возрастающую нагрузку на конечность начинали не ранее 18 месяцев после снятия аппарата. Средний срок реабилитационного лечения составил 21±2,5 месяца.
Влияние запора на организм
Если у ребенка запор, то он становится вялым, апатичным, снижается аппетит, появляется слабость на фоне всасывания вредных веществ из каловых масс, вследствие расстройства пищеварения.
Если ребенку не сходить в туалет, то это становится причиной его замкнутости, так как походы на горшок заканчиваются неприятными ощущениями и длительны по времени.
Нарушение отхождения стула приводит к появлению дисбаланса в составе микрофлоры кишечника, возникает нарушение всасывании и поступления питательных веществ, возникает дефицит микроэлементов у ребенка. Запор может стать причиной воспаления в стенке кишечника, повышению его моторики и возникновению сильных болей.
Запор нужно лечить, начиная с общих рекомендаций.
Патогенетический механизм
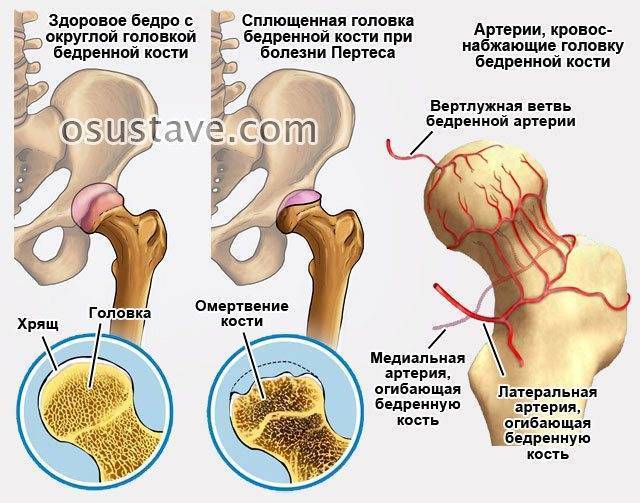
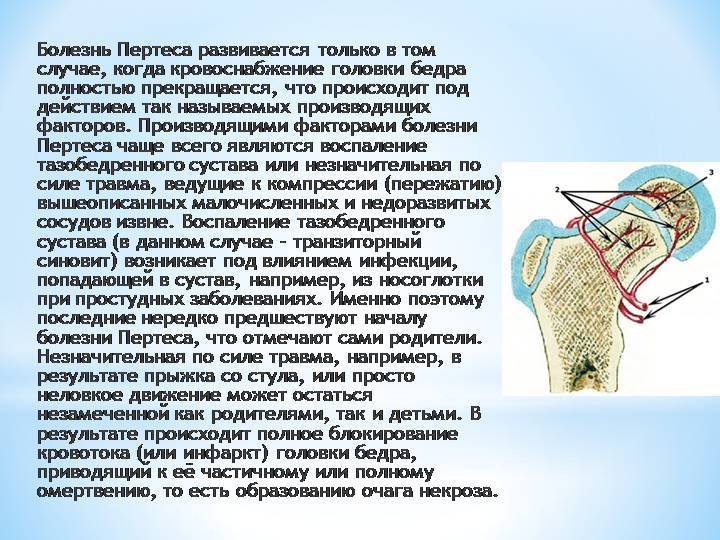
При развитии миелодисплазии происходит сбой иннервации в суставах, а также снижается число сосудов, которые транспортируют кровеносные тельца к их тканям. Получается, что вместо 10 артерий и вен крупного размера в районе головки бедра у больного есть только 2 недоразвитых сосуда небольшого диаметра. В результате такого процесса ткани регулярно страдают от недостатка кровоснабжения. Неблагоприятное влияние оказывает и изменение тонуса из-за проблем с иннервацией.
В относительно опасных условиях, например, при частичном пережатии артерий и вен вследствие воспалительной реакции, у пациентов с типичным количеством сосудов ухудшается кровоснабжение, но остается в достаточном числе. У ребенка с миелодисплазией в таких же ситуациях кровь прекращает поступать к головке бедра. В результате недостатка кислорода и полезных веществ некоторые ткани отмирают, то есть образуется зона асептического некроза, которые прогрессирует без микроорганизмов и факторов воспаления.
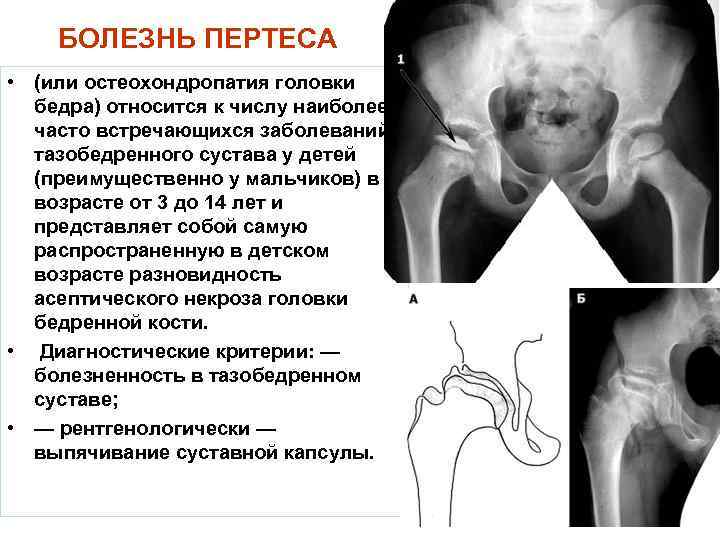
Что может стать причиной развития болезни Пертеса?
На сегодняшний день взгляды разных исследователей на причины развития болезни Пертеса значительно расходятся. Однако наиболее распространенная теория, к которой склоняется большинство учёных во всём мире, состоит в том, что определяющим условием возникновения болезни Пертеса является присутствие у ребенка определенных приобретенных или врожденных факторов. Так называемым «фоном» для развития болезни Пертеса считают миелодисплазию (недоразвитие спинного мозга) поясничного отдела, который непосредственно отвечает за иннервацию тазобедренного сустава. Недоразвитие спинного мозга носит наследственно-врожденный обусловленный характер, различается по степеням тяжести и наблюдается у значительной части детей. Легкая степень миелодисплазии может на протяжении всей жизни так и остаться незамеченной, тогда как более существенные нарушения в развитии спинного мозга проявляются целым рядом ортопедических заболеваний, к числу которых и относится болезнь Пертеса. Однако, хочется отметить, что данное заболевание развивается исключительно в случае полного прекращения кровоснабжения головки бедренной кости, что происходит под влиянием таких факторов как воспалительное поражение тазобедренного сустава или его травмирование, приводящие к пережатию извне недоразвитых и малочисленных сосудов. Помимо этого к предполагаемым причинам развития этой болезни относят болезни обмена веществ, осложнения инфекционных заболеваний, чрезмерную нагрузку на суставы (особенно при ослабленном организме).
К факторам риска развития болезни Пертеса относятся:
-
Высокие постоянные физические нагрузки у детей, чей рост уменьшен по сравнению с детьми своей возрастной группы;
-
Дети, которые подвержены воздействию табачного дыма (пассивные курильщики);
-
Дети, перенесшие рахит и гипотрофию.
Замечено, что чаще болезнь Пертеса встречается у мальчиков в возрасте от 3-х до 14 лет – они болеют в 3-5 раз чаще девочек. Статистика также утверждает, что мальчики, родившиеся с весом менее 2-х килограммов, в 5 раз чаще предрасположены к данному заболеванию, чем те, которые весили больше 3,5 килограммов.
Симптоматика
Вначале возникают несильные тупые болезненные ощущения во время передвижений. Зачастую боль появляется в районе тазобедренного сустава, но в отдельных ситуациях может локализоваться в районе коленного или по всей нижней конечности. Ребенок постепенно начинает слегка прихрамывать, припадать на пораженную ногу или подволакивать ее. Обычно в этот момент клинические симптомы так слабо выражены, что родители совсем не думают о том, чтобы обратиться к врачу. Проявления объясняются ушибами, чрезмерной нагрузкой, последствиями инфекционной болезни и прочими нарушениями.
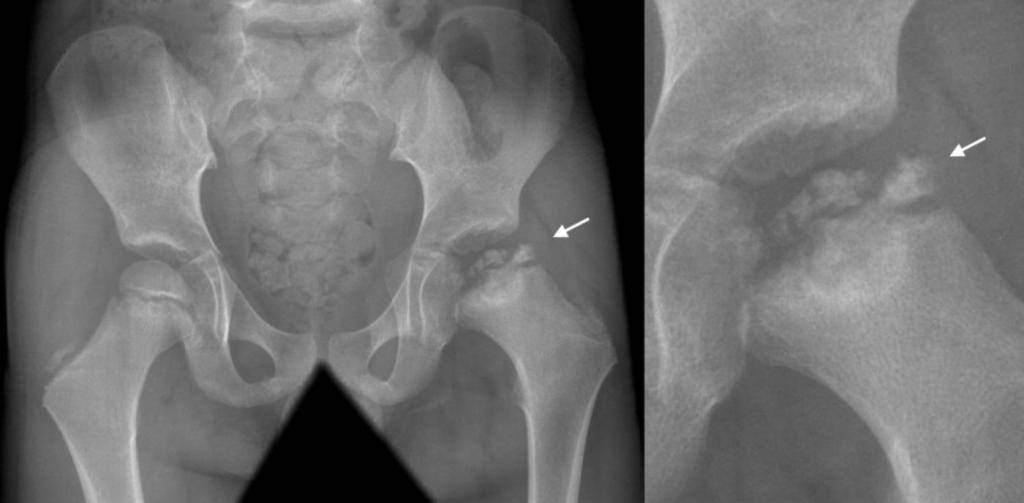
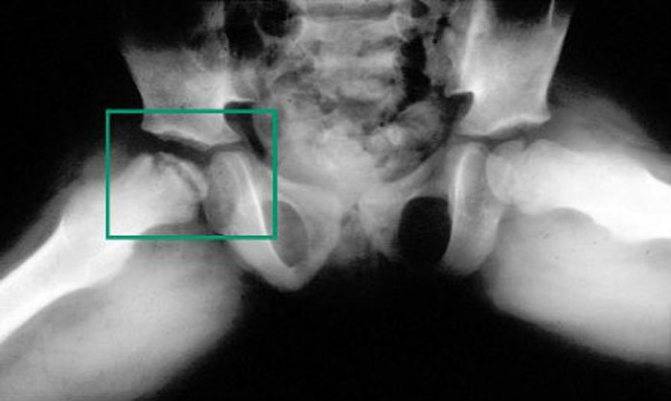
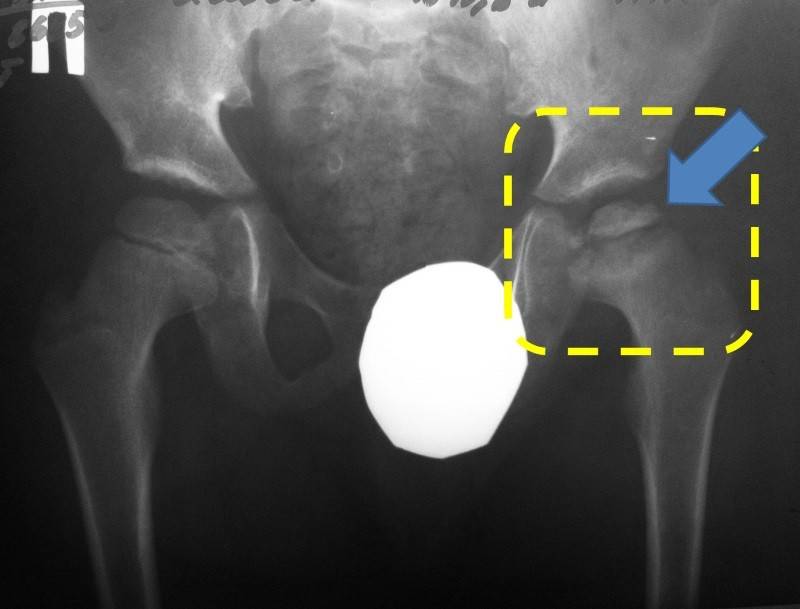
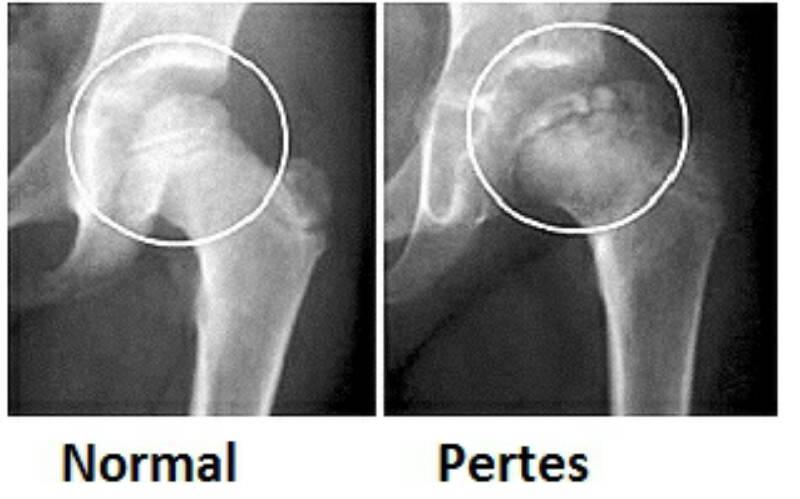
Когда разрушение головки продолжается дальше и появляется импрессионный перелом, боль заметно возрастает, а хромота заметна выражена. Мягкие ткани в районе сустава опухают. Врачи диагностируют ограничение двигательной активности:
- отсутствие возможности вывернуть ногу наружу;
- невозможность вращения нижней конечностью;
- ходьба затруднена;
- пациент не может сгибать и разгибать ногу.
Врачи отмечают развитие вегетативных нарушений в дистальных областях пораженного участка тела. У пациента может появиться высокая температура. В дальнейшем болезненные ощущения ослабляются, опора на ногу восстанавливается, но хрома и ограничения движений могут остаться. В некоторых случаях отмечается укорочение ноги. С течением времени появляется симптоматика прогрессирующего артроза. Если у вашего ребенка есть вышеописанные проявления, то стоит незамедлительно записаться на консультацию к врачу. Предупредите заболевание на начальной стадии, чтобы не бороться с его последствиями потом.
Полезные сведения
Представленное отклонение носит патологический характер и выделяется сбоем кровоснабжения и дальнейшим некрозом головки бедра. В медицине аномалия считается распространенной и составляет приблизительно 17% от всех случаев остеохондропатий. Больше всего поражению подвержены лица возрастом от 3 до 14 лет. Болезнь имеет гендерную предрасположенность, из-за чего мальчики в 5–6 раз чаще страдают от отклонений, чем девочки. Однако врачи говорят, что у вторых отмечается склонность к более тяжелому течению болезни. Поражение бывает как односторонним, так и двусторонним, при этом второй сустав часто меньше травмируется и быстрее восстанавливается.
Основные причины
Сейчас окончательного источника формирования заболевания ученые не нашли. Они предполагают, что это полиэтиологическое нарушение, в развитие которого значение несет не только наследственный фактор, но и проблемы с метаболизмом, а также влияние окружающей среды. Наиболее популярная теория, что аномалия встречается у детей с миелодисплазией — недоразвитием поясничного отдела спинного мозга врожденного типа. Это отклонение может никак не проявляться в жизни или же стать причиной образования разнообразных ортопедических проблем. Исследователи считают, следующие факторы стартовыми моментами нарушения:
- минимальные механические повреждения;
- воспалительные реакции в тазобедренном суставе в случае проникновения в организм микробных и вирусных микроорганизмов;
- изменения гормонального фона, когда наступает переходной возраст;
- сбои в обменных процессах, где участвует кальций, фосфор и прочие минералы, участвующие в формировании костей.
В конкретных ситуациях определяется генетическая предрасположенность человека к прогрессированию болезни Пертеса, обусловленная склонностью к миелодисплазии и наследственными особенностями структуры тазобедренного сустава.
Почему мальчики не болеют
Учитывая, что мутирующий ген несет в себе Х-хромосома, то девочки в плане заболевания находятся в более «выигрышной» позиции. У них присутствует две Х-хромосомы. Поэтому если одна из них «бракованная», то вторая функционирует нормально. Это дает девочке хоть малый шанс на нормальное существование.
У мальчика Х-хромосома одна. Если она имеет мутационный ген, значит, выпадает из работы полностью, и ее нечем заменить. Такие малыши мужского пола, как правило, погибают еще внутриутробно, так и не родившись. Поэтому синдром Ретта у мальчиков встречается крайне редко.
Но, несмотря на такую особенность заболевания, очень редко, но все-таки мальчики с подобным синдромом выживают. Это может быть связано с тем, что не все гены в Х-хромосоме подвергаются мутации. Из-за этого заболевание развивается не столь остро.
Другая причина – наличие у мальчика синдрома Клайнфельтера. При этом наблюдается полисомия половых хромосом, то есть их набор составляет ХХУ. И, если одна Х-хромосома имеет патологический ген, то вторая может регулировать синтез белка и дарить мальчику возможность жизни. Получается такая же картина, как и у девочки.
ЗАКЛЮЧЕНИЕ
Представленная технология центрирующей остеотомии бедра в сочетании с неартикулирующей аппаратной декомпрессией, туннелизацией шейки и головки, субхондральной клеточно-тканевой трансплантацией может эффективно применяться при лечении тяжелых форм болезни Пертеса в качестве альтернативы известным хирургическим вмешательствам.
ЛИТЕРАТУРА
1.Гафаров Х. З. Лечение детей и подростков с ортопедическими заболеваниями нижних конечностей. Казань : Татарское кн. изд-во, 1995.
2.Заболевания тазобедренного сустава у детей / И. Ахтямов, А. Абакаров, А. Белецкий, А. Богосьян, О. Соколовский. Казань : Центр оперативной печати, 2008. 456 с.
3.Минеев К .П., Белякова Л. А. Клинико-теоретическое обоснование активной хирургической тактики при комплексном лечении болезни Пертеса. М.: Сибирская книга, 1997. 112 с.
4.Моделирующее влияние тройной остеотомии таза на проксимальный отдел бедра при болезни Пертеса. /О.А. Соколовский, А. Б. Деменцов, А. В. Белецкий, Г. А. Бродко // Новости хирургии. 2009. Т. 17, No 3. С. 112-120.
5.Шевцов В. И., Макушин В. Д. Остеохондропатия тазобедренного сустава. М.: Медицина, 2007. 352 с.
6.A paired study of Perthes’ disease comparing conservative and surgical treatment / M. Kamegaya, T. Saisu, N. Ochiai, J. Hisamitsu, H. Moriya // J.Bone Joint Surg. Br. 2004. Vol. 86-B, No 8. P. 1176-1178.
7.Avascular necrosis of the femoral head in childhood: the results of treatment with articulated distraction / M. Kucukkaya, Y. Kabukcuoglu, I. Ozturk, U. Kuzgun // J. Paediatr. Orthop. 2000. Vol. 20, No 6. P. 722-728.
8.Arthrodiastasis in Perthes’ disease. Preliminary results / S.L. Maxwell, K.J. Lappin, W.D. Kealey, B.C. McDowell, A.P. Cosgrove // J. Bone Joint Surg. Br. 2004. Vol. 86-B. No 2. P. 244-250.
9.Arthrodiastasis of the hip / G.A. Hosny, K. El-Deeb, M. Fadel, M. Laklouk // J. Pediatr. Orthop. 2011. Vol. 31, Suppl. 2. P. 229-234. doi: 10.1097/BPO.0b013e318223b45a.
10.Baker K., Brown T., Brand R. A finite-element analysis of the effects of intertrochanteric osteotomy on stresses in femoral head necrosis // Clin. Orthop. Relat. Res. 1989. Vol. 249. P.183-188.
11.Catterall A. The natural history of Perthes’ disease // J. Bone Joint Surg. Br. 1976. Vol. 53-B, No 1. P. 37-53.
12.Femoral osteotomy in Perthes’ disease. Results at maturity / C.J. Coates, J.M. Paterson, K.R. Woods, A. Catterall, J.A. Fixsen // J. Bone Joint Surg. Br. 1990. Vol. 72-B, No 4. P. 581-585.
13.Hefti F., Clarke N.M. The management of Legg-Calve ́-Perthes’ disease: is there a consensus? : A study of clinical practice preferred by the members of the European Paediatric Orthopaedic Society // J. Child. Orthop. 2007. Vol. 1, No 1. P. 19–25. doi: 10.1007/s11832-007-0010-z.
14.Herring J.A., Kim H.T., Browne R. Legg-Calve-Perthes disease. Part II: prospective multicenter study of the effect of treatment on outcome // J.Bone Joint Surg. Am. 2004. Vol. 86-A, No 10. P. 2121-2134.
15.Ilizarov fixator for the treatment of Legg-Calve-Perthes disease / M. Kocaoglu, O.I. Kilicoglu, S.B. Goksan, M. Cakmak // J. Pediatr. Orthop. B. 1999. Vol. 8, No 4. P. 276-281.
16.Innominate osteotomy in Legg-Calve-Perthes disease / S.T. Canale, A.F. D’Anca, J.M. Cotler, H.E. Snedden // J. Bone Joint Surg. Am. 1972. Vol. 54-A, No 1. P. 25-40.
17.Innominate osteotomy for Perthes’ disease / M. Stevens, P. Williams, M. Menelaus // J. Pediat. Orthop. 1981. Vol. 1, No 1. P. 47-54.
18.Intertrochanteric varus osteotomy for Perthes’disease. Radiographic changes after 2-16-year follow-up of 126 hips / V. Hoikka, M. Poussa, T.Yrjönen, K. Osterman // Acta Orthop. Scand. 1991. Vol. 62. No 6. P. 549-553.
19.Joseph B., Srinivas G., Thomas R. Management of Perthes disease of late onset in southern India. The evaluation of a surgical method // J Bone Joint Surg. Br. 1996. 78-B, No 4. P. 625-630.
20.Klisic P. J. Treatment of Perthes’ disease in older children // J. Bone Joint Surg. Br. 1983. Vol. 65-B, No 4. P. 419-427
Сведения об авторах:
1.Тёпленький Михаил Павлович – ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова» Минздрава России, заведующий травматолого-ортопедическим отделением No 9, заведующий лабораторией патологии суставов, д. м. н.
2.Парфёнов Эдуард Михайлович – ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова» Минздрава России, травматолого-ортопедическое отделение No 9, врач ортопед-травматолог.